
【题目】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A的某种原子无中子,B的最外层有3个成单电子,C与A可形成1:1和1:2的化合物且常温下呈液体,D的原子半径是短周期中最大的,F的最高价氧化物对应水化物是最强的含氧酸,C和E形成的氧化物有两性,G的最高能层符号为N, 且其内层的d轨道电子数与最外层电子数相等。

(1)G原子的价电子排布式为_____________。
(2)BA3的VSEPR模型为_____________。
(3)离子半径C2->D+,原因是_____________。
(4)E与F形成的化合物EF3 在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_____________(标明配位键),其中该蒸气分子中E原子的杂化方式为_________。
(5)A、B、C三种元素可形成盐,则在形成的盐中存在的作用力有_____________。
(6)图甲是G单质的堆积方式,该堆积方式为__________堆积;GC2·H2O可通过CF4水解来制备,则该制备过程的化学方程式为_____________。
(7)A、D、E可形成化合物DEA4 ,在DEA4晶体中,与D+紧邻且等距的EA4-有_____个;DEA4晶体的密度为_____________g/cm3(用含a的代数式表示)。若DEA4晶胞上下底心处的D+被Li+取代,得到的晶体为__________(填化学式)。
【答案】 3d24s2 四面体形 O2和Na+的离子核外电子层结构完全相同,但Na+的质子数更多,对外层电子的吸引能力比O2更强,所以Na+半径更小 ![]() sp3杂化 共价键、离子键、配位键 ABABAB(或六方最密) TiCl4+3H2O=TiO2·H2O+4HCl 8
sp3杂化 共价键、离子键、配位键 ABABAB(或六方最密) TiCl4+3H2O=TiO2·H2O+4HCl 8 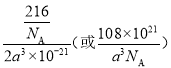 Na3Li(AlH4)4
Na3Li(AlH4)4
【解析】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A的某种原子无中子,A是H;B的最外层有3个成单电子,N是N;C与A可形成1:1和1:2的化合物且常温下呈液体,C是O;D的原子半径是短周期中最大的,D是Na;F的最高价氧化物对应水化物是最强的含氧酸,F是Cl;C和E形成的氧化物有两性,E是Al;G的最高能层符号为N,且其内层的d轨道电子数与最外层电子数相等,即原子序数是22,是Ti,则
(1)Ti原子的价电子排布式为3d24s2。(2)NH3分子中N原子价层电子对数是3+(5-3×1)/2=4,因此VSEPR模型为四面体形。(3)由于O2和Na+的离子核外电子层结构完全相同,但Na+的质子数更多,对外层电子的吸引能力比O2更强,所以Na+半径更小;(4)E与F形成的化合物EF3 在178℃时升华,其蒸气的相对分子质量约为267,这说明是氯化铝的二聚体,其中氯原子是配体,因此蒸气分子的结构式为![]() ,其中该蒸气分子中Al原子的价层电子对数是4,其杂化方式为sp3杂化。(5)A、B、C三种元素可形成盐,该盐是铵盐,其盐中存在的作用力有共价键、离子键、配位键。(6)根据Ti单质的堆积方式可知该堆积方式为ABABAB(或六方最密)堆积;TiO2·H2O可通过TiCl4水解来制备,则根据原子守恒可知该制备过程的化学方程式为TiCl4+3H2O=TiO2·H2O+4HCl。(7)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为4×54/NAg÷[(a×10-7 cm)2×2a×10-7 cm]=108×1021/NAa3gcm-3;若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li(AlH4)4。
,其中该蒸气分子中Al原子的价层电子对数是4,其杂化方式为sp3杂化。(5)A、B、C三种元素可形成盐,该盐是铵盐,其盐中存在的作用力有共价键、离子键、配位键。(6)根据Ti单质的堆积方式可知该堆积方式为ABABAB(或六方最密)堆积;TiO2·H2O可通过TiCl4水解来制备,则根据原子守恒可知该制备过程的化学方程式为TiCl4+3H2O=TiO2·H2O+4HCl。(7)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为4×54/NAg÷[(a×10-7 cm)2×2a×10-7 cm]=108×1021/NAa3gcm-3;若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li(AlH4)4。


科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法不正确的是
A. 冬天用的暖贴是利用铁的吸氧腐蚀原理放热
B. Na2S2O5可用作葡萄酒的添加剂
C. 食盐可用作食品调味剂和防腐剂
D. 制造普通玻璃的原料是石灰石、黏土和石英
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0 mol·L1的浓硫酸稀释成2.00 mol·L1的稀硫酸100 mL,实验操作如下:
A.将配好的稀硫酸倒入试剂瓶中,贴好标签;
B.盖好容量瓶塞,反复颠倒,摇匀;
C.用量筒量取_______mL的18.0 mol·L1的浓硫酸;
D.将______________沿烧杯内壁慢慢注入盛有少量______________的烧杯中;
E.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入_______mL的容量瓶中;
G.改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2 cm处。
(1)填写上述步骤中的空白:
C:____________;D :将____________注入_____________;F:____________。
(2)将上面操作步骤按正确的进行排序______________(用字母表示)。
(3)试分析下列操作会使所配溶液的浓度偏高的是_______(填序号)。
①量取浓硫酸时俯视读数;
②转移溶液前,容量瓶中含有少量蒸馏水;
③溶解硫酸用的烧杯、玻璃棒未洗涤;
④未冷却至室温定容;
⑤定容时俯视容量瓶的刻度线;
⑥定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是
A.2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B.200 mL 1 mol·L1氯化钙溶液中c(Cl)和100 mL 2 mol·L1氯化钾溶液中c(Cl)
C.64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 氨基酸既能与强酸反应也能与强碱反应,但蛋白质不行。
D. 分离沸点相差30℃以上的两种有机物通常使用重结晶的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中收载“烧酒”篇:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”《本草经集注》中记载有关于鉴别消石(KNO3)和朴消(Na2SO4)之法:以火烧之,紫青烟起,云是真消石也”。文字中两处渉及到“法”。分别是
A. 蒸馏 焰色反应 B. 萃取 升华
C. 蒸馏 丁达尔效应 D. 升华 焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有中学化学中常见的几种物质:①HNO3 ②Zn ③CO ④CO2 ⑤Fe(NO3)3 ⑥Cl2。请回答下列问题:
(1)①②③④四种物质中常用作还原剂的有__________(填序号)。
(2)①②在一定条件下发生反应:4Zn+10HNO3===4Zn(NO3)2+N2O↑+5H2O,反应中硝酸体现的性质是__________和__________,被还原的HNO3与未被还原的HNO3的质量比为__________。
(3)工业上可用⑤⑥制备净水剂高铁酸钠,其反应为:Fe(NO3)3+NaOH+Cl2 →Na2FeO4+NaNO3+NaCl
+H2O。
①配平该反应的化学方程式,并用单箭头法标出电子转移方向和数目:________________。
②氧化剂与还原剂物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com