
【题目】![]() 是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
(1)已知:![]() ,
,![]() ,
,![]() 。设计最简单的方法鉴别
。设计最简单的方法鉴别![]() 和
和![]() 两种固体: __________________________________。
两种固体: __________________________________。
(2)利用下图装置(略去夹持仪器)制备

已知:![]() ;酸性条件下,
;酸性条件下,![]() 和
和![]() 均能与
均能与![]() 迅速反应生成
迅速反应生成![]() 和
和![]() 。
。
①装置A中发生反应的离子方程式为__________________________________;
这样安放铜丝比将铜片浸于液体中的优点是__________________________。
②装置B中反应的化学方程式为________________________________。
③干燥剂X的名称为__________,其作用是____________________。
④上图设计有缺陷,请在F方框内将装置补充完全,并填写相关试剂名称___________。
(3)测定产品的纯度。
取![]() 制取的样品溶于水配成
制取的样品溶于水配成![]() 溶液,取
溶液,取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 酸性
酸性![]() 溶液进行滴定,实验所得数据如下表:
溶液进行滴定,实验所得数据如下表:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次滴定实验数据异常的原因可能是______(填字母序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,定为滴定终点
D.滴定终点时俯视读数
②酸性![]() 溶液滴定
溶液滴定![]() 溶液的离子方程式为__________________。
溶液的离子方程式为__________________。
③该样品中![]() 的质量分数为__________。
的质量分数为__________。
【答案】分别取等量的两种固体样品少量于试管中加水至溶解,再分别滴加酚酞试液,变红的为NaNO2 Cu+4H++2NO3-= Cu2++2NO2↑+2H2O 可以控制反应的发生与停止 3NO2+H2O =2HNO3+NO 碱石灰 吸收B中挥发出的硝酸和水蒸气 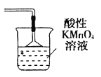 A 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 69%(或
A 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 69%(或![]() )
)
【解析】
(1) 根据NaCl、NaNO2盐的组成及溶液的酸碱性分析判断;
(2)装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮和硝酸铜和水,NO2与装置B中的水反应产生HNO3和NO,通过装置C中的干燥剂吸收水蒸气,在装置D中与Na2O2发生反应,装置E中的干燥剂防止水蒸气进入,通过装置E中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气。
(3)①第一次实验数据出现异常,消耗KMnO4溶液体积偏大,根据c(待测)=![]()
分析不当操作对V(标准)的影响,以此判断浓度的误差;
②在反应中NO2-被氧化为NO3-,MnO4-被还原为Mn2+;
③根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可求出亚硝酸钠的物质的量,然后求样品中亚硝酸钠的质量分数。
(1) NaCl是强酸强碱盐,不水解,溶液显中性;NaNO2是强碱弱酸盐,NO2-水解,消耗水电离产生的H+,最终达到平衡时溶液中c(OH-)>c(H+),溶液显碱性,所以可根据盐溶液的酸碱性的不同进行鉴别。分别取等量的两种固体样品少量于试管中加水至溶解,然后分别滴加酚酞试液,溶液变红的为NaNO2,不变色的为NaCl;
(2)①在装置A中Cu与浓硝酸发生反应,产生硝酸铜、二氧化氮和水,反应的离子方程式为:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O;这样安放铜丝,可通过上下移动铜丝控制反应是否进行,所以使用铜丝的优点是可以控制反应的发生与停止;
②装置B中水与二氧化氮反应生成硝酸和一氧化氮,反应方程式为3NO2+H2O =2HNO3+NO;
③在干燥管中盛放的干燥剂X的名称为碱石灰,其作用是吸收B中挥发出的硝酸和水蒸气;
④NO及NO2都是大气污染物,随意排入大气会造成大气污染,故上图设计的缺陷是无尾气吸收装置。可根据NO、NO2都会被酸性KMnO4溶液吸收,产物都在溶液中,为防止倒吸现象的发生,在导气管末端安装一个倒扣的漏斗,装置为 ;
;
(3)①A.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,根据c(待测)=![]() 分析可知,造成V(标准)偏大,A可能;
分析可知,造成V(标准)偏大,A可能;
B.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,B不可能;
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,就定为滴定终点,此时溶液中NO2-未反应完全,消耗标准溶液体积偏小,C不可能;
D.滴定终点时俯视读数,造成V(标准)偏小,D不可能;
故合理选项是A;
②在反应中NO2-被氧化为NO3-,MnO4-被还原为Mn2+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
③消耗KMnO4溶液体积V=![]() =20.00mL,消耗高锰酸钾的物质的量是n(MnO4-)=0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量n(NaNO2)=0.002mol×
=20.00mL,消耗高锰酸钾的物质的量是n(MnO4-)=0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量n(NaNO2)=0.002mol×![]() =0.005mol,则原样品中亚硝酸钠的物质的量是n(NaNO2)总=0.005mol×
=0.005mol,则原样品中亚硝酸钠的物质的量是n(NaNO2)总=0.005mol×![]() =0.02mol,其质量m(NaNO2)=0.02mol×69g/mol=1.38g,则样品中亚硝酸钠的质量分数
=0.02mol,其质量m(NaNO2)=0.02mol×69g/mol=1.38g,则样品中亚硝酸钠的质量分数![]() ×100%=69.0%。
×100%=69.0%。


科目:高中化学 来源: 题型:
【题目】下列溶液中的粒子浓度关系正确的是( )
A.![]() 溶液中:
溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.等体积、等物质的量浓度的![]() 和弱酸
和弱酸![]() 混合后的溶液中:
混合后的溶液中:![]()
D.室温下,![]() 的柑橘汁中
的柑橘汁中![]() 是
是![]() 的牛奶中
的牛奶中![]() 的1000倍
的1000倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属配合物的一些特有性质的研究正受到许多研究人员的关注,因为这方面的研究无论是理论上还是工业应用上都有重要意义。
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

(1)此配离子中含有的作用力有__________ (填序号)。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)此配合物中碳原子的杂化轨道类型有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见的四种有机物的比例模型示意图。下列说法正确的是( )

A. 甲能使酸性高锰酸钾溶液褪色
B. 乙可与溴水发生取代反应使溴水褪色
C. 丙在铁作催化剂条件下与溴水发生取代反应
D. 丁在浓硫酸、加热条件下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:

下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:![]()
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu+在酸性条件下能发生下列反应:Cu+![]() Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
A. 该反应显示硫酸具有酸性
B. NH4CuSO3中铜元素全部被氧化
C. 刺激性气味的气体是氨气
D. 反应中硫酸作氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯和苯都是重要的化工原料,请回答下列问题。
(1)甲烷的电子式为__________,写出在光照条件下,甲烷与氯气发生反应生成气态有机物的化学方程式:________。
(2)下列叙述不正确的是________
A. CH4与C4H10互为同系物 B. C5H12有3种同分异构体
C. 烷烃的卤代反应很难得到纯净物 D. 烷烃分子中,相邻的三个碳原子可能在同一条直线
(3) 下列物质不可能是乙烯加成产物的是(__________)
A. CH3CH3 B. CH3CHCl2 C. CH3CH2OH D. CH3CH2Br
(4)若将乙烯通入到紫色高锰酸钾溶液中,可以观察到__________,乙烯发生的反应类型为________。
(5) 苯的结构简式:________,它与液溴在催化剂作用下发生取代反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com