
【题目】下列溶液中的粒子浓度关系正确的是( )
A.![]() 溶液中:
溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.等体积、等物质的量浓度的![]() 和弱酸
和弱酸![]() 混合后的溶液中:
混合后的溶液中:![]()
D.室温下,![]() 的柑橘汁中
的柑橘汁中![]() 是
是![]() 的牛奶中
的牛奶中![]() 的1000倍
的1000倍
【答案】D
【解析】
A.NaHCO3溶液中碳酸氢根离子水解程度大于电离程度,溶液显碱性,则NaHCO3溶液中存在c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.任何电解质溶液中都存在物料守恒和电荷守恒,根据物料守恒得①c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),根据电荷守恒得②c(Na+)+ c(H+)=2c(S2-)+c(HS-)+ c(OH-),将①代入②得:c(HS-)+2c(H2S)= c(OH-)-c(H+),故B错误;
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中,无法判断电离程度和水解程度,不能判断溶液的酸碱性,即无法比较c(OH-)和c(H+)的大小,溶液中必满足电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-)和物料守恒2c(Na+)=c(X-)+c(HX),故C错误;
D.pH=3.5的柑橘汁中c(H+)=10-3.5,pH=6.5的牛奶中c(H+)=10-6.5,所以pH=3.5的柑橘汁中c(H+)是pH=6.5的牛奶中c(H+)的1000倍,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生意义重大。一种回收铅的工作流程如下:
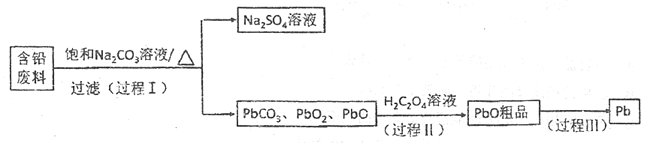
(1)铅和碳元素同主族,比碳多4个电子层,则铅元素的原子序数为______;铅蓄电池放电对,PbO2作______极。
(2)过程Ⅰ,已知:PbSO4、PbCO3的溶解度(20℃)见图1;相关物质溶解度见图2。

图1 图2
①根据图1写出过程Ⅰ的离子方程式: __________________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低;
ii.___________________(请你提出一种合理解释)
(3)过程Ⅱ:发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑
请写出草酸的电子式________。PbO与Al2O3性质相似,PbO与氢氧化钠溶液反应的离子方程式是______________________。
(4)过程Ⅲ:将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb,如图。

①阴极的电极反应式是_____________________。
②电解一段时间后,Na2PbCl4浓度极大下降,为了能使电解过程持续进行,阴极区采取的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( )

A.a电极上的电极反应式为N2H4+2O2-+4e-=N2↑+2H2O
B.电池内电路中,电流方向:电极a→电极b
C.当电极a上消耗1molN2H4时,电极b上被氧化的O2在标准状况下体积为22.4L
D.b极附近的pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K时,实验测得溶液中的反应:H2O2+2HI=2H2O+I2,在不同浓度时的化学反应速率见表,由此可推知当c(HI)=0.500mol·L-1,c(H2O2)=0.400mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
A.0.0380mol·L-1·s-1B.0.152mol·L-1·s-1
C.0.608mol·L-1·s-1D.0.760mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1 molCH4转移12 mol电子
3H2+CO,每消耗1 molCH4转移12 mol电子
B. 电极B上发生的电极反应:O2+2CO2+4e-=2CO32-
C. 电池工作时,CO32-向电极B移动
D. 电极A上H2参与的电极反应:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中_____________________族,AB2的结构式为______________
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( )

A. 溶液中c(A2+)增大
B. B极的电极反应:B-2e-=B2+
C. Y电极上有Cl2产生,发生还原反应
D. 反应初期,X电极周围出现白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
是一种工业盐,外观与食盐非常相似,毒性较强。请按要求回答下列问题:
(1)已知:![]() ,
,![]() ,
,![]() 。设计最简单的方法鉴别
。设计最简单的方法鉴别![]() 和
和![]() 两种固体: __________________________________。
两种固体: __________________________________。
(2)利用下图装置(略去夹持仪器)制备

已知:![]() ;酸性条件下,
;酸性条件下,![]() 和
和![]() 均能与
均能与![]() 迅速反应生成
迅速反应生成![]() 和
和![]() 。
。
①装置A中发生反应的离子方程式为__________________________________;
这样安放铜丝比将铜片浸于液体中的优点是__________________________。
②装置B中反应的化学方程式为________________________________。
③干燥剂X的名称为__________,其作用是____________________。
④上图设计有缺陷,请在F方框内将装置补充完全,并填写相关试剂名称___________。
(3)测定产品的纯度。
取![]() 制取的样品溶于水配成
制取的样品溶于水配成![]() 溶液,取
溶液,取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 酸性
酸性![]() 溶液进行滴定,实验所得数据如下表:
溶液进行滴定,实验所得数据如下表:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次滴定实验数据异常的原因可能是______(填字母序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.当观察到最后一滴溶液滴入待测液中红色慢慢褪去,定为滴定终点
D.滴定终点时俯视读数
②酸性![]() 溶液滴定
溶液滴定![]() 溶液的离子方程式为__________________。
溶液的离子方程式为__________________。
③该样品中![]() 的质量分数为__________。
的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com