
【题目】下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
B | 向FeCl3+3KSCN | 体系颜色无变化 | KCl不能使该平衡移动 |
C | 向浓度均为0.1mol·L-1NaOH和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
A.AB.BC.CD.D
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】用Fe做阳极,碳棒做阴极在U形管中电解饱和食盐水时。下列说法错误的是( )
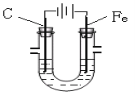
A.阳极可得到氯气
B.阴极发生的反应是:2H++2e—= H2↑
C.最终溶液中有红褐色沉淀产生
D.向阴极附近溶液中滴加酚酞时,溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某无色溶液用激光笔照射无丁达尔现象,加入FeCl3后溶液显色.下列各组微粒在此溶液可以大量共存的是
A.Na+、K+、Fe2+、Cl-
B.K+、Fe2+、NO3-、Fe(OH)3(胶体)
C.Cl-、SCN-、NH4+、葡萄糖分子
D.OH-、Na+、苯酚、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1 g镁铝合金溶于60 mL 5.0mol·L![]() H
H![]() SO
SO![]() 溶液中,完全溶解后再加入a mL10.0 mol·L
溶液中,完全溶解后再加入a mL10.0 mol·L![]() 的NaOH溶液,此时溶液中的Mg
的NaOH溶液,此时溶液中的Mg![]() 、Al
、Al![]() 恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
(1)当加入a=_________mLNaOH溶液时,可使溶液中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。沉淀的最大值为__________ g。
恰好完全沉淀。沉淀的最大值为__________ g。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积___________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如下:

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是____________;“滤渣1”的主要成分为____________。
(2)“转化Ⅰ”的目的为___________________(用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为__________________。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,________(选填“能”或“不能”)达到目的,“试剂X”可以是________(填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________;“转化Ⅱ”中发生反应的离子方程式为________。
(6)工业上也可取“滤液2”,利用电沉积法制取金属Ni,电解装置如下。电解过程中镍棒上可能发生的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.![]() 点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
C.![]() 点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2 ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是
A.用图 装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
装置精炼铜,则a极为粗铜,电解质CuSO4溶液浓度变小
B.图 表示反应2SO2(g)+O2(g)
表示反应2SO2(g)+O2(g) ![]() 2SO3(g)增大O2的浓度对反应速率的影响
2SO3(g)增大O2的浓度对反应速率的影响
C.图 表示中和热测定的实验装置图
表示中和热测定的实验装置图
D.图 装置盐桥中KCl的Cl-移向左烧杯
装置盐桥中KCl的Cl-移向左烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
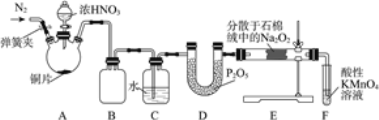
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
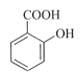 +(CH3CO)2O
+(CH3CO)2O![]()
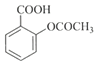 +CH3COOH
+CH3COOH
水杨酸 酸酐 乙酰水杨酸
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~74 | 135~138 |
相对密度/(g/cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中最好采用__________加热(填标号)。
A. 酒精灯 B.热水浴 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号)。
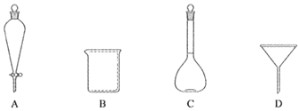
(3)①中需使用冷水,目的是_________________________。
(4)②中的主要化学反应方程式是:____________________。
(5)④采用的纯化方法为____________。
(6)本实验的产率为_________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com