
【题目】用Fe做阳极,碳棒做阴极在U形管中电解饱和食盐水时。下列说法错误的是( )
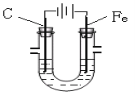
A.阳极可得到氯气
B.阴极发生的反应是:2H++2e—= H2↑
C.最终溶液中有红褐色沉淀产生
D.向阴极附近溶液中滴加酚酞时,溶液变红
【答案】A
【解析】
A. 该电解池用Fe做阳极,因此阳极为Fe失电子放电,发生反应Fe-2e-=Fe2+,A项错误;
B. 阴极为溶液中水电离的氢离子得电子生成氢气,同时生成氢氧根离子,发生反应:2H2O+2e- = H2↑+2OH-(或2H++2e- = H2↑),B项正确;
C. 该电解池总的反应方程式为:Fe+2H2O![]() Fe(OH)2+H2↑,生成的Fe(OH)2被空气中的氧气氧化生成氢氧化铁红褐色沉淀,C项正确;
Fe(OH)2+H2↑,生成的Fe(OH)2被空气中的氧气氧化生成氢氧化铁红褐色沉淀,C项正确;
D. 阴极为溶液中水电离的氢离子得电子生成氢气,同时生成氢氧根离子,发生反应:2H2O+2e- = H2↑+2OH-,因此阴极溶液呈碱性,则向阴极附近溶液中滴加酚酞时,溶液变红,
D项正确;
答案选A。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地诉说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式________________________________。
(2)下列说法正确的是________。
a.H2S、O3分子都是直线形
b.BF3和NH3均为三角锥形
c.CO2、HCN分子的结构式分别是O=C=O、H—C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
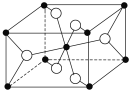
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图, 白球表示________原子。
(4)乙酸(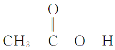 )熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
)熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出该二聚体的结构:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.合成氨工业用铁触媒作催化剂
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。

请回答:
(1)加入的A是__________,检验A已过量的方法是___________。
(2)加入的B是__________,加入稍过量B的目的是__________。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
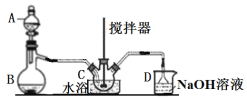
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.l mol ·L1的H2SO4溶液:NH4+、Fe2+、Cl、NO3-
B.0.l mol ·L1的FeCl3溶液:K+、Al3+、SO42-、NO3-
C.0.l mol ·L1的Na2SO3溶液:Ba2+、K+、ClO-、MnO4-
D.0.l mol ·L1的Ba(OH)2溶液:Mg2+、Na+、HCO3-、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.向KClO3溶液中滴加稀盐酸:ClO3-+Cl-+6H+=Cl2↑+3H2O
C.向Al2(SO4)3溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
B | 向FeCl3+3KSCN | 体系颜色无变化 | KCl不能使该平衡移动 |
C | 向浓度均为0.1mol·L-1NaOH和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com