
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
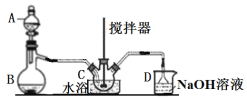
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
【答案】蒸馏烧瓶 Na2SO3+H2SO4=Na2SO4+H2O+SO2↑ 将浓硫酸缓缓加入浓硝酸,边加边搅拌 温度太高,浓硝酸会挥发和分解 生成的![]() 作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴
作为该反应的催化剂 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复 84.67%
【解析】
(1)仪器B的名称为蒸馏烧瓶。
(2)B中为固体与液体反应产生SO2,所以应为亚硫酸钠与硫酸反应。
(3)①实验前浓硝酸和浓硫酸混合的操作,类似于浓硫酸稀释。
②C中反应温度不能太高,主要从浓硝酸的性质进行分析。
③温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,应考虑可能是催化作用。
后,反应明显加快,应考虑可能是催化作用。
(4) ①草酸钠与高锰酸钾溶液反应,生成Mn2+、CO2和H2O。
②滴定终点时,起初为浅紫色,则后来为无色。
③先利用草酸钠求出过量KMnO4的物质的量,再求出与![]() 反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
反应的KMnO4的物质的量,从而求出亚硝酰硫酸的纯度。
(1)仪器B的名称蒸馏烧瓶。答案为:蒸馏烧瓶;
(2)B中Na2SO3与H2SO4反应生成SO2,其化学方程式为Na2SO3+H2SO4
=Na2SO4+H2O+SO2↑。答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(3)①实验前浓硝酸和浓硫酸混合,相当于浓硫酸稀释,其操作为将浓硫酸缓缓加入浓硝酸中,边加边搅拌。答案为:将浓硫酸缓缓加入浓硝酸中,边加边搅拌;
②C中反应温度不能太高的原因为温度太高,浓硝酸会挥发和分解。答案为:温度太高,浓硝酸会挥发和分解;
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是生成的
后,反应明显加快,其原因可能是生成的![]() 作为该反应的催化剂。答案为:生成的
作为该反应的催化剂。答案为:生成的![]() 作为该反应的催化剂;
作为该反应的催化剂;
(4)①草酸钠与高锰酸钾溶液反应的离子方程式为2MnO4-+5C2O42-+16H+
=2Mn2++10CO2↑+8H2O。答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②滴定终点的现象为滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复。答案为:滴入最后一滴![]() 溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
溶液后,溶液由浅紫色变为无色且半分钟颜色不恢复;
③设与C2O42-反应的MnO4-的物质的量为x
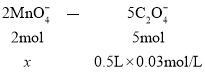
从而求出x=0.006mol,则与![]() 反应的KMnO4物质的量为0.01mol-0.006mol
反应的KMnO4物质的量为0.01mol-0.006mol
=0.004mol。
设![]() 的物质的量为y
的物质的量为y
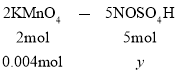
从而求出y=0.01mol,亚硝酰硫酸的纯度![]()
![]() =84.67%。答案为:84.67%。
=84.67%。答案为:84.67%。


科目:高中化学 来源: 题型:
【题目】![]() 是生活中常见的物质,请回答下列问题:
是生活中常见的物质,请回答下列问题:
(1)写出![]() 在水溶液中电离的方程式:______________。
在水溶液中电离的方程式:______________。
(2)![]() 属于“酸”“碱”“盐”中的________________________。
属于“酸”“碱”“盐”中的________________________。
(3)①写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:___________________________。
溶液反应的离子方程式:___________________________。
②写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:_____________________________________。
溶液反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液Y可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验
中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验![]() 假设气体全部逸出,忽略
假设气体全部逸出,忽略![]() 分解
分解![]() 下列说法不正确的是
下列说法不正确的是![]()

A.溶液Y中一定不存在![]() 、
、![]()
B.溶液Y中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.溶液Y中一定存在![]() ,且
,且![]()
D.溶液Y中可能存在![]() ,为了确定是否存在,可取溶液通过焰色反应验证
,为了确定是否存在,可取溶液通过焰色反应验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
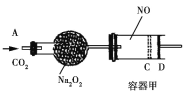
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Fe做阳极,碳棒做阴极在U形管中电解饱和食盐水时。下列说法错误的是( )
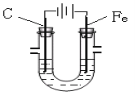
A.阳极可得到氯气
B.阴极发生的反应是:2H++2e—= H2↑
C.最终溶液中有红褐色沉淀产生
D.向阴极附近溶液中滴加酚酞时,溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
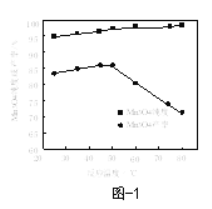
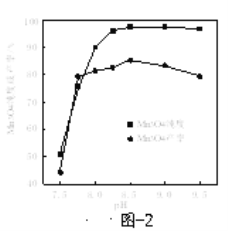
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C.SO2通入BaCl2溶液有白色沉淀BaSO3生成
D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法错误的是
ZnO+2Ni(OH)2。下列说法错误的是

A.放电过程中OH通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OHe=NiOOH+H2O
C.放电时负极反应为Zn+2OH2e=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.![]() 点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
C.![]() 点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2 ClO-=Cl-+ClO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com