
ΓΨΧβΡΩΓΩ”ΟΖΫ«ΠΩσ(÷ς“Σ≥…Ζ÷ΈΣPbSΘ§Κ§”–‘”÷ FeSΒ»)ΚΆ»μΟΧΩσ(÷ς“Σ≥…Ζ÷ΈΣMnO2Θ§ΜΙ”–…ΌΝΩFe2O3Θ§Al2O3Β»‘”÷ ) ÷Τ±ΗPbSO4ΚΆMn3O4ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚΔΌΫΰ»Γ÷–÷ς“ΣΖ¥”ΠΘΚPbSΘΪMnO2ΘΪ4HClΘΫMnCl2ΘΪPbCl2ΘΪSΘΪ2H2O
ΔΎPbCl2Ρ―»ή”ΎάδΥ°Θ§“Ή»ή”Ύ»»Υ°ΘΜPbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) ΓςHΘΨ0
PbCl42-(aq) ΓςHΘΨ0
ΔέMn3O4 «ΚΎ…Ϊ≤Μ»ή”ΎΥ°ΒΡΙΧΧεΘ§÷Τ±Η‘≠άμΈΣΘΚ6MnCl2ΘΪO2ΘΪ12NH3H2OΘΫ2Mn3O4ΓΐΘΪ12NH4ClΘΪ6H2O
Δή≤ΩΖ÷Ϋπ τάκΉ”ΩΣ Φ≥ΝΒμΚΆ≥ΝΒμΆξ»ΪΒΡpH»γœ¬(ΩΣ Φ≥ΝΒμΒΡpHΑ¥Ϋπ τάκΉ”≈®Ε»ΈΣ0.1molΓΛL1ΦΤΥψ)ΓΘ
Ϋπ τάκΉ” | Fe2+ | Fe3+ | Al3+ | Mn2+ |
ΩΣ Φ≥ΝΒμΒΡpH | 7.6 | 2.7 | 4.0 | 7.7 |
≥ΝΒμΆξ»ΪΒΡpH | 9.6 | 3.7 | 5.2 | 9.8 |
Θ®1Θ©ΓΑΫΰ»ΓΓ±–ηΩΊ÷ΤΈ¬Ε»‘Ύ80ΓφΉσ”“Θ§ΈΣΦ”ΩλΥαΫΰΥΌ¬ Θ§ΜΙΩ…≤…”ΟΒΡΖΫΖ® «______ΓΘ
Θ®2Θ©Φ”»κ±ΞΚΆNaCl»ή“ΚΒΡΡΩΒΡ «______ΓΘ
Θ®3Θ©ΓΑΫΰ»ΓΓ±Ιΐ≥Χ÷–MnO2ΫΪFe2+―θΜ·ΒΡάκΉ”ΖΫ≥Χ ΫΈΣ______ΓΘ
Θ®4Θ©”ΟMnCO3ΒςΫΎ»ή“ΚpHΒΡΖΕΈßΈΣ______ΓΘ
Θ®5Θ©ΓΑ≥Ο»»≥ι¬ΥΓ±ΒΡΡΩΒΡ «______ΓΘ
Θ®6Θ©“―÷ΣΘΚΖ¥”ΠΈ¬Ε»ΚΆ»ή“ΚpHΕ‘Mn3O4ΒΡ¥ΩΕ»ΚΆ≤ζ¬ ”ΑœλΖ÷±π»γΆΦ1ΓΔΆΦ2Υυ ΨΘ§«κ≤Ι≥δΆξ’ϊ”…¬Υ“ΚX÷Τ±ΗMn3O4ΒΡ Β―ιΖΫΑΗΘΚ______Θ§’φΩ’Η…‘ο4–Γ ±ΒΟ≤ζΤΖMn3O4ΓΘΘ® Β―ι÷––κ Ι”ΟΒΡ ‘ΦΝΘΚΑ±Υ°ΓΔΩ’ΤχΘ©
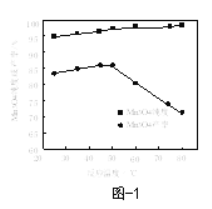
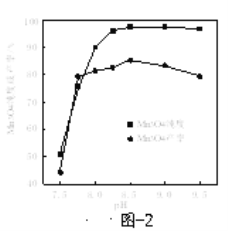
ΓΨ¥πΑΗΓΩΖέΥιΩσ ·ΜρΫΝΑηΜρ Β±‘ωΦ”―ΈΥα≈®Ε» ‘ω¥σPbCl2ΒΡ»ήΫβΕ» 2Fe2+ΘΪMnO2ΘΪ4H+ΘΫMn2+ΘΪ2Fe3+ΘΪ2H2O 5.2ΓήpHΘΦ7.7 PbCl2ΫΒΈ¬“ΉΫαΨßΈω≥ωΘ§≥Ο»»≥ι¬Υ”–άϊ”Ύ«ΠΒΡΜ·ΚœΈο”κ≤Μ»ή–‘‘”÷ Ζ÷άκ ΫΪ¬Υ“ΚXΥ°‘ΓΦ”»»≤Δ±Θ≥÷50ΓφΘ§”ΟΑ±Υ°ΒςΫΎ»ή“ΚpH≤ΔΈ§≥÷‘Ύ8.5Ήσ”“Θ§‘Ύ≤ΜΕœΫΝΑηœ¬Θ§±ΏΆ®Ω’Τχ±ΏΦ”Α±Υ°Θ§÷±÷Ν”–¥σΝΩΚΎ…Ϊ≥ΝΒμ…ζ≥… ±Θ§Ψ≤÷ΟΘ§‘Ύ…œ≤ψ«ε“Κ÷–ΦΧ–χΒΈΦ”Α±Υ°≤Μ‘Ό”–≥ΝΒμ…ζ≥…Θ§Ιΐ¬ΥΘ§œ¥Β”≥ΝΒμ2~3¥Έ÷±÷Νœ¥Β”“ΚΦλ―ι≤Μ≥ωCl
ΓΨΫβΈωΓΩ
Ήœ»ΫΪΖΫ«ΠΩσΚΆ»μΟΧΩσΦ”―ΈΥαΚΆ±ΞΚΆ¬»Μ·ΡΤ»ή“ΚΫΰ»ΓΘ§ΖΫ≥Χ ΫΧβΗ…“―Ψ≠Ηχ≥ωΘ§Ϋ”œ¬ά¥Ιΐ¬ΥΒΟΒΫΒΡ¬Υ‘ϋIΈΣΒΞ÷ ΝρΦΑΤδΥϊ≤Μ»ή–‘‘”÷ Θ§Ϋ”œ¬ά¥Φ”»κΧΦΥαΟΧΒςΫΎpHΘ§≥Ο»»≥ι¬ΥΩ…“‘±Θ≥÷¬»Μ·«Π»ήΫβ‘ΎΥ°÷–Θ§Εχ≤Μ»ή–‘‘”÷ ±ΜΙΐ¬ΥΘ§‘Όά以Ιΐ¬ΥΦ¥Ω…ΒΟΒΫ¥ΩΨΜΒΡ¬»Μ·«ΠΘ§¬Υ“ΚX÷–ΒΡ¬»Μ·ΟΧ‘ΌΆ®ΙΐΧβΗ…Ηχ≥ωΒΡΖΫ≥Χ Ϋ÷Τ±ΗΥΡ―θΜ·»ΐΟΧΘ§Εχ¬»Μ·«Π”κΝρΥαΡΤ»ή“ΚΖ¥”ΠΩ…“‘ΉΣΜ·ΈΣΗϋΡ―»ήΒΡΝρΥα«Π≥ΝΒμΘ§Ψί¥Υά¥Ζ÷ΈωΦ¥Ω…ΓΘ
Θ®1Θ©ΈΣΦ”Ωλ»ήΫβΘ§Έ“Ο«Ω…“‘Ά®ΙΐΫΝΑηΓΔΖέΥιΩσ ·ά¥‘ω¥σΫ”¥ΞΟφΜΐΓΔ Β±ΧαΗΏ―ΈΥαΒΡ≈®Ε»ΖΫΖ®ΘΜ
Θ®2Θ©±ΞΚΆ¬»Μ·ΡΤ»ή“Κ÷–”–¥σΝΩΒΡ![]() Θ§Ω…“‘¥ΌΫχΧβΗ…÷–Ηχ≥ωΒΡΖ¥”ΠΔΎΒΡ’ΐœρΫχ––Θ§‘ω¥σ¬»Μ·«ΠΒΡ»ήΫβΕ»ΘΜ
Θ§Ω…“‘¥ΌΫχΧβΗ…÷–Ηχ≥ωΒΡΖ¥”ΠΔΎΒΡ’ΐœρΫχ––Θ§‘ω¥σ¬»Μ·«ΠΒΡ»ήΫβΕ»ΘΜ
Θ®3Θ©Εΰ―θΜ·ΟΧ÷–+4ΦέΒΡΟΧ”–«Ω―θΜ·–‘Θ§![]() ΨΏ”–ΜΙ‘≠–‘Θ§Εΰ’ΏΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”ΠΘΚ
ΨΏ”–ΜΙ‘≠–‘Θ§Εΰ’ΏΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”ΠΘΚ![]() ΘΜ
ΘΜ
Θ®4Θ©ΒςΫΎpHΒΡΡΩΒΡ «ΫΪ»ή“Κ÷–≥ΐΟΧ“‘ΆβΒΡΤδΥϋΫπ τάκΉ”≥ΐ»ΞΘ§ΗυΨίΧβΡΩΗχ≥ωΒΡ±μΗώΩ…“‘ΖΔœ÷Β±![]() ±
±![]() ΚΆ
ΚΆ![]() “―Ψ≠≥ΝΒμΆξ»ΪΘ§»τ
“―Ψ≠≥ΝΒμΆξ»ΪΘ§»τ![]() ±ΟΧΫΪΩΣ Φ≥ΝΒμΘ§‘λ≥…≤ζΈοΒΡΥπ ßΘ§“ρ¥ΥΉνΦ―pHΖΕΈßΈΣ
±ΟΧΫΪΩΣ Φ≥ΝΒμΘ§‘λ≥…≤ζΈοΒΡΥπ ßΘ§“ρ¥ΥΉνΦ―pHΖΕΈßΈΣ![]() ΘΜ
ΘΜ
Θ®5Θ©ΧβΡΩΗφ÷ΣΈ“Ο«¬»Μ·«Π“Ή»ή”Ύ»»Υ°Θ§Ρ―»ή”ΎάδΥ°Θ§“ρ¥Υ≥Ο»»Ιΐ¬ΥΩ…ΫΪ¬»Μ·«Π±Θ≥÷‘Ύ»ή“Κ÷–Θ§≤Μ»ή–‘ΤδΥϋΫπ τΜ·ΚœΈοΫΪ±ΜΙΐ¬Υ≥ΐ»ΞΘΜ
Θ®6Θ©ΗυΨίΧβΆΦ≤ΜΡ―Ω¥≥ωΘ§50ΓφΚΆpH8.5Ήσ”“ «ΉνΦ―ΒΡΖ¥”ΠΧθΦΰΘ§“ρ¥ΥΈ“Ο«ΫΪ¬Υ“ΚXΥ°‘ΓΦ”»»≤Δ±Θ≥÷50ΓφΘ§”ΟΑ±Υ°ΒςΫΎ»ή“ΚpH≤ΔΈ§≥÷‘Ύ8.5Ήσ”“Θ§‘Ύ≤ΜΕœΫΝΑηœ¬Θ§±ΏΆ®Ω’Τχ±ΏΦ”Α±Υ°Θ§÷±÷Ν”–¥σΝΩΚΎ…Ϊ≥ΝΒμ…ζ≥… ±Θ§Ψ≤÷ΟΘ§‘Ύ…œ≤ψ«ε“Κ÷–ΦΧ–χΒΈΦ”Α±Υ°≤Μ‘Ό”–≥ΝΒμ…ζ≥…Θ§Ιΐ¬ΥΘ§œ¥Β”≥ΝΒμ2~3¥Έ÷±÷Νœ¥Β”“ΚΦλ―ι≤Μ≥ω![]() Φ¥Ω…ΓΘ
Φ¥Ω…ΓΘ


 ―τΙβΩΈΧΟΩΈ ±”≈Μ·Ής“ΒœΒΝ–¥πΑΗ
―τΙβΩΈΧΟΩΈ ±”≈Μ·Ής“ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν– Β―ιΕ‘”ΠΟη ωΦΑΫα¬έ’ΐ»ΖΒΡ «

A.…œœ¬“ΤΕ·ΆΦΔΌΉσ≤ύΝΩΤχΙήΘ§ΝΫ≤ύ“ΚΟφ±Θ≥÷Β»ΗΏΘ§÷ΛΟςΤχΟή–‘ΝΦΚΟ
B.ΆΦΔΎΩ…“‘Ζά÷ΙΒΙΈϋΘ§Ρή”ΟΉςΡ≥–©Ζ¥”ΠΒΡΑ≤»ΪΤΩ
C.ΆΦΔέΩ…“‘”Οά¥÷Τ»Γ≤Δ ’Φ·…ΌΝΩΑ±Τχ
D.ΝΩ»Γ10.00mL“ΚΧε ±Θ§Τπ Φ ±ΤΫ ”ΕΝ ΐΘ§÷’Βψ ±»γΆΦΔήΥυ ΨΕΝ ΐΘ§ΝΩ»Γ“ΚΧεΧεΜΐΤΪ–Γ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΗςΉι»»Μ·―ßΖΫ≥Χ Ϋ÷–Θ§Μ·―ßΖ¥”ΠΒΡΓςH«Α’Ώ–Γ”ΎΚσ’ΏΒΡ”–( )
ΔΌC(s)+O2(g)®TCO2(g) ΓςH1 C(s)+![]() O2(g)®TCO(g) ΓςH2
O2(g)®TCO(g) ΓςH2
ΔΎS(s)+O2(g)®TSO2(g) ΓςH3 S(g)+O2(g)®TSO2(g) ΓςH4
Δέ2H2(g)+O2(g)®T2H2O(l) ΓςH5 2H2(g)+O2(g)®T2H2O(g) ΓςH6
ΔήCaCO3(s)®TCaO(s)+CO2(g) ΓςH7 CaO(s)+H2O(l)®TCa(OH)2(s) ΓςH8
Δί![]() H2SO4(≈®)+NaOH(aq)=
H2SO4(≈®)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΠΛH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΠΛH10
Na2SO4(aq)+H2O(l) ΠΛH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΠΛH10
ΔόN2O4(g)![]() 2NO2(g) ΓςH11 2NO2(g)
2NO2(g) ΓςH11 2NO2(g)![]() N2O4(g) ΓςH12
N2O4(g) ΓςH12
A.2œνB.3œνC.4œνD.5œν
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΔΝΩ‘ΣΥΊ≈πΚΆΟΨΕ‘÷≤ΈοΒΡ“ΕΒΡ…ζ≥ΛΚΆ»ΥΧεΙ«ςάΒΡΫΓΩΒ”–Ή≈ °Ζ÷÷Ί“ΣΒΡΉς”ΟΘ§ΤδΜ·ΚœΈο“≤”Π”ΟΙψΖΚΓΘ
(1)ΜυΧ§B‘≠Ή”ΒΡΒγΉ”≈≈≤ΦΆΦΈΣ________________________Θ§ΤδΒΎ“ΜΒγάκΡή±»Be___________Θ®ΧνΓΑ¥σΓ±ΜρΓΑ–ΓΓ±Θ©ΓΘ
(2)»ΐΦέB“Ή–Έ≥…≈δάκΉ”Θ§»γ[B(OH)4]Θ≠ΓΔ[BH4]Θ≠Β»ΓΘ[B(OH)4]Θ≠ΒΡΫαΙΙΦρ ΫΈΣ___________ (±ξ≥ω≈δΈΜΦϋ)Θ§Τδ÷––Ρ‘≠Ή”ΒΡ‘”Μ·ΖΫ ΫΈΣ________Θ§–¥≥ω[BH4]Θ≠ΒΡ“Μ÷÷―τάκΉ”Β»ΒγΉ”Χε_______ΓΘ
Θ®3Θ©œ¬ΆΦ±μ ΨΕύ≈πΥαΗυΒΡ“Μ÷÷Έόœό≥ΛΒΡΝ¥ ΫΫαΙΙΘ§ΤδΜ·―ß ΫΩ…±μ ΨΈΣ____________(“‘n±μ Ψ≈π‘≠Ή”ΒΡΗω ΐ)ΓΘ

Θ®4Θ©≈πΥαΨßΧε «Τ§≤ψΫαΙΙΘ§œ¬ΆΦ±μ ΨΒΡ «Τδ÷–“Μ≤ψΒΡΫαΙΙΓΘΟΩ“Μ≤ψΡΎ¥φ‘ΎΒΡΉς”ΟΝΠ”–_________ΓΘ

(5)»ΐ¬»Μ·≈πΒΡ»έΒψ±»¬»Μ·ΟΨΒΡ»έΒψΒΆΘ§‘≠“ρ «_______________________ΓΘ
(6)ΟΨΒΞ÷ ΨßΧε÷–‘≠Ή”ΒΡΕ―ΜΐΡΘ–Ά»γœ¬ΆΦΘ§ΥϋΒΡΕ―ΜΐΡΘ–ΆΟϊ≥ΤΈΣ_______ΘΜΫτΝΎΒΡΥΡΗωΟΨ‘≠Ή”ΒΡ÷––ΡΝ§œΏΙΙ≥…ΒΡ’ΐΥΡΟφΧεΦΗΚΈΧεΒΡΧεΜΐ «2a cm3Θ§ΟΨΒΞ÷ ΒΡΟήΕ»ΈΣΠ― gΓΛcmΘ≠3Θ§“―÷ΣΑΔΖϋΌΛΒ¬¬ό≥Θ ΐΈΣNAΘ§‘ρΟΨΒΡΡΠΕϊ÷ ΝΩΒΡΦΤΥψ Ϋ «________________ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―«œθθΘΝρΥα![]() «»ΨΝœΓΔ“Ϋ“©Β»ΙΛ“ΒΒΡ÷Ί“Σ‘≠ΝœΘΜ»ή”Ύ≈®ΝρΥαΘ§Ω…‘Ύ≈®ΝρΥα¥φ‘Ύ ±”Ο
«»ΨΝœΓΔ“Ϋ“©Β»ΙΛ“ΒΒΡ÷Ί“Σ‘≠ΝœΘΜ»ή”Ύ≈®ΝρΥαΘ§Ω…‘Ύ≈®ΝρΥα¥φ‘Ύ ±”Ο![]() ΚΆ≈®œθΥαΖ¥”Π÷ΤΒΟΓΘ Β―ι “”Ο»γΆΦΉΑ÷Ο÷Τ±Η…ΌΝΩ―«œθθΘΝρΥαΘ®Φ–≥÷ΉΑ÷Ο¬‘Θ©Θ§≤Δ≤βΕ®≤ζΤΖΒΡ¥ΩΕ»ΓΘ
ΚΆ≈®œθΥαΖ¥”Π÷ΤΒΟΓΘ Β―ι “”Ο»γΆΦΉΑ÷Ο÷Τ±Η…ΌΝΩ―«œθθΘΝρΥαΘ®Φ–≥÷ΉΑ÷Ο¬‘Θ©Θ§≤Δ≤βΕ®≤ζΤΖΒΡ¥ΩΕ»ΓΘ
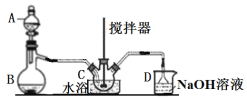
(1)“«ΤςBΒΡΟϊ≥Τ____________ΓΘ
(2)B÷–≤ζ…ζSO2Θ§ΤδΜ·―ßΖΫ≥Χ ΫΈΣ_______________________________________ΓΘ
(3)»ΐΨ±…’ΤΩC÷–≈®œθΥα”κ![]() ‘Ύ≈®ΝρΥαΉς”Οœ¬Ζ¥”Π÷ΤΒΟ
‘Ύ≈®ΝρΥαΉς”Οœ¬Ζ¥”Π÷ΤΒΟ![]()
ΔΌ Β―ι«Α≈®œθΥαΚΆ≈®ΝρΥαΜλΚœΒΡ≤ΌΉςΈΣ______________________________________ΓΘ
ΔΎC÷–Ζ¥”ΠΈ¬Ε»≤ΜΡήΧΪΗΏΒΡ‘≠“ρΈΣ___________________________________ΓΘ
Δέ”ΟάδΥ°‘ΓΈ§≥÷CΈ¬Ε»≤Μ±δΘ§ΩΣ ΦΖ¥”ΠΫœ¬ΐΘ§¥ΐ…ζ≥……ΌΝΩ![]() ΚσΘ§Ζ¥”ΠΟςœ‘Φ”ΩλΘ§Τδ‘≠“ρΩ…Ρή «______________________ΓΘ
ΚσΘ§Ζ¥”ΠΟςœ‘Φ”ΩλΘ§Τδ‘≠“ρΩ…Ρή «______________________ΓΘ
(4)≤βΕ®≤ζΤΖΒΡ¥ΩΕ»
ΉΦ»Ζ≥Τ»Γ1.5g≤ζΤΖΖ≈»κΉΕ–ΈΤΩ÷–Θ§Φ”»κ![]() ΓΔ100.00mLΒΡ
ΓΔ100.00mLΒΡ![]() »ή“ΚΚΆΉψΝΩœΓΝρΥαΘ§“Γ‘»≥δΖ÷Ζ¥”ΠΓΘ»ΜΚσ”Ο0.5000mol/L≤ίΥαΡΤ±ξΉΦ»ή“ΚΒΈΕ®Θ§œϊΚΡ≤ίΥαΡΤ»ή“ΚΒΡΧεΜΐΈΣ30.00mLΓΘ
»ή“ΚΚΆΉψΝΩœΓΝρΥαΘ§“Γ‘»≥δΖ÷Ζ¥”ΠΓΘ»ΜΚσ”Ο0.5000mol/L≤ίΥαΡΤ±ξΉΦ»ή“ΚΒΈΕ®Θ§œϊΚΡ≤ίΥαΡΤ»ή“ΚΒΡΧεΜΐΈΣ30.00mLΓΘ
“―÷ΣΘΚ![]()
ΔΌ≤ίΥαΡΤ”κΗΏΟΧΥαΦΊ»ή“ΚΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________________________________ΓΘ
ΔΎΒΈΕ®÷’ΒψΒΡœ÷œσΈΣ______________________________________________ΓΘ
Δέ―«œθθΘΝρΥαΒΡ¥ΩΕ»![]() ________ΓΘ[±ΘΝτ»ΐΈΜ”––ß ΐΉ÷Θ§M(NOSO4H)=127g/mol]
________ΓΘ[±ΘΝτ»ΐΈΜ”––ß ΐΉ÷Θ§M(NOSO4H)=127g/mol]
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩXΓΔYΓΔZΓΔMΓΔRΈΣΈε÷÷ΕΧ÷ήΤΎ‘ΣΥΊΘ§Τδ‘≠Ή”ΑκΨΕΚΆΉνΆβ≤ψΒγΉ” ΐ÷°ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
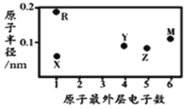
A.ΦρΒΞ―τάκΉ”ΑκΨΕXΉν–Γ
B.MΒΡ«βΜ·Έο≥ΘΈ¬≥Θ―Ιœ¬ΈΣΤχΧεΘ§Ζ÷Ή”ΦδΈό«βΦϋ
C.ΉνΗΏΦέ―θΜ·ΈοΒΡΥ°Μ·ΈοΒΡΥα–‘:Z<Y
D.X”κYΩ…“‘–Έ≥…ΤΫΟφ–ΈΫαΙΙΒΡΖ÷Ή”Θ§Ζ÷Ή”÷–¥φ‘ΎΦΪ–‘Ι≤ΦέΦϋΚΆΖ«ΦΪ–‘Ι≤ΦέΦϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ(1)±»Ϋœ―θΜ·–‘œύΕ‘«Ω»θΘΚCl2_______I2(ΧνΓΑ)Γ±ΘΨΓΑΘΦΓ±ΜρΓΑ=Γ±)ΘΜ”Ο“ΜΗωάκΉ”ΖΫ≥Χ ΫΥΒΟςCl2ΚΆI2―θΜ·–‘ΒΡœύΕ‘«Ω»θ_______ΓΘ
(2)NH5 «άκΉ”Μ·ΚœΈοΘ§Ης‘≠Ή”ΉνΆβ≤ψ¬ζΉψΈ»Ε®ΫαΙΙΓΘ–¥≥ωNH5ΒΡΒγΉ” Ϋ__________ΓΘ
(3)«κ”ΟœΒΆ≥ΟϋΟϊΖ®Ε‘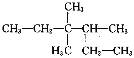 ΟϋΟϊ__________ΓΘ
ΟϋΟϊ__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΚ§+6ΦέΗθΒΡΖœΥ°ΕΨ–‘«ΩΘ§Ε‘ΜΖΨ≥Έέ»Ψ―œ÷ΊΘ§ΙΛ“Β…œ≥Θάϊ”ΟΜ·―ß‘≠άμΑ―+6ΦέΗθΉΣΜ·ΈΣ≤Μ»ή–‘Cr(OH)3≥ΐ»ΞΓΘ
ΔώΓΔSO2ΜΙ‘≠Ζ®ΘΚΜ·ΙΛ≥ß≥Θ”ΟSO2¥ΠάμΚ§ΗθΖœΥ°Θ§ΤδΙΛ“’Νς≥Χ»γœ¬ΆΦΥυ ΨΘΚ
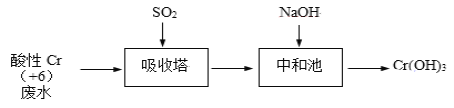
“―÷ΣΘΚCr2O72- + H2O ![]() 2CrO42- + 2H+Θ§Έϋ ’Υΰ÷– Cr2O72-”κSO2Ζ¥”Π»γœ¬ΘΚCr2O72©¹(aq)+3SO2(g)+2H+(aq)®T2Cr3+(aq)+3SO42©¹(aq)+H2O(l) ΠΛH = -1145 kJ/molΓΘ
2CrO42- + 2H+Θ§Έϋ ’Υΰ÷– Cr2O72-”κSO2Ζ¥”Π»γœ¬ΘΚCr2O72©¹(aq)+3SO2(g)+2H+(aq)®T2Cr3+(aq)+3SO42©¹(aq)+H2O(l) ΠΛH = -1145 kJ/molΓΘ
Θ®1Θ©ΤδΥϊΧθΦΰ≤Μ±δΘ§―–ΨΩΈϋ ’Υΰ÷–pHΕ‘Ζ¥”ΠΒΡ”ΑœλΓΘ
pH | 2 | 4 | 6 |
CrΘ®+6Θ©Ήν¥σ»Ξ≥ΐ¬ | 99.99%¥ο≈≈Ζ≈±ξΉΦ | 99.95%¥ο≈≈Ζ≈±ξΉΦ | 99.5%Έ¥¥ο≈≈Ζ≈±ξΉΦ |
±Φδ | 30 min | 35 min | 45 min |
ΔΌ”……œ ω ΐΨίΜώΒΟΒΡΫα¬έ”–_________ΓΘ
ΔΎ ΒΦ ΙΛ“Β…ζ≤ζΩΊ÷ΤpH = ____Ήσ”“ΓΘ
Δέœ¬Ν–ΥΒΖ®≤ΜΚœάμΒΡ «_____ΓΘ
a.ΗΟΥα–‘Κ§ΗθΖœΥ°÷–“ΜΕ®Κ§”–CrO42-Θ§pH‘Ϋ¥σΤδΚ§ΝΩ‘ΫΗΏ
b.ΤδΥϊΧθΦΰ≤Μ±δΘ§‘ω¥σ―Ι«ΩΘ§Έϋ ’Υΰ÷–Ζ¥”ΠΒΡK‘ω¥σΘ§”–άϊ”Ύ≥ΐ»ΞCrΘ®+6Θ©
c.άμ¬έ…œΩ¥Θ§SO32-ΓΔFe2+Β»“≤Ω…“‘”Ο”Ύ≥ΐ»ΞCrΘ®+6Θ©
Θ®2Θ©ΤδΥϊΧθΦΰ≤Μ±δΘ§―–ΨΩΈ¬Ε»Ε‘CrΘ®+6Θ©»Ξ≥ΐ¬ ΒΡ”ΑœλΘ®»γΆΦΥυ ΨΘ©ΓΘ
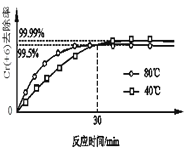
“―÷ΣΘΚ30min«ΑœύΆ§ ±ΦδΡΎΘ§80ΓφΒΡCrΘ®+6Θ©»Ξ≥ΐ¬ ±»40ΓφΗΏΘ§ «“ρΈΣ30min«ΑΖ¥”Π’ΐœρΫχ––Θ§Έ¬Ε»ΗΏΖ¥”ΠΥΌ¬ ΩλΖ¥”ΠΈοΒΡΉΣΜ·¬ ‘ω¥σΘΜ ‘Ϋβ Ά30minΚσ80ΓφΒΡCrΘ®+6Θ©»Ξ≥ΐ¬ ΒΆΒΡ‘≠“ρΘΚ________ΓΘ
ΔρΓΔΒγΫβΖ®¥ΠάμΘΚ
ΙΛ“Β…œ¥ΠάμΚ§Cr2O72-άκΉ”ΒΡΥα–‘ΖœΥ°Θ§≤…”ΟΆυΙΛ“ΒΖœΥ°÷–Φ”»κ ΝΩΒΡ ≥―ΈΘ§‘Ό”ΟFeΈΣΒγΦΪΫχ––ΒγΫβΘ§ΫΪCr2O72ΓΣάκΉ”ΜΙ‘≠ΈΣΩ…»ή–‘»ΐΦέΗθάκΉ”Θ§‘ΌΒςpH Ι»ΐΦέΗθάκΉ”±δΈΣ≤Μ»ή–‘«β―θΜ·Έο≥ΐ»ΞΓΘ
Θ®1Θ©Φ”»κ ≥―ΈΒΡΡΩΒΡ « _______ΘΜ
Θ®2Θ©ΒγΫβ ±―τΦΪΖ¥”Π ΫΈΣ _________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΆΦ Ψ”κΕ‘”ΠΒΡ–π ωœύΖϊΒΡ «![]()
A.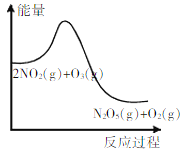 ΆΦΥυ ΨΒΡΖ¥”ΠΘ§»τ…ΐΗΏΈ¬Ε»Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±δ–Γ
ΆΦΥυ ΨΒΡΖ¥”ΠΘ§»τ…ΐΗΏΈ¬Ε»Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ±δ–Γ
B.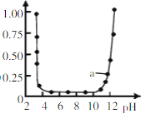 ΆΦΥυ ΨΒΡ «
ΆΦΥυ ΨΒΡ «![]() ”κ
”κ![]() Ζ¥”Π ±Κ§¬ΝΈΔΝΘ≈®Ε»±δΜ·«ζœΏΘ§ΆΦ÷–aΒψ»ή“Κ÷–¥σΝΩ¥φ‘Ύ
Ζ¥”Π ±Κ§¬ΝΈΔΝΘ≈®Ε»±δΜ·«ζœΏΘ§ΆΦ÷–aΒψ»ή“Κ÷–¥σΝΩ¥φ‘Ύ![]()
C.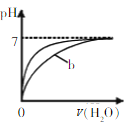 ±μ ΨΒ»pHΒΡ―ΈΥα”κ¥ΉΥα÷–Ζ÷±πΦ”Υ°œΓ ΆΒΡpH±δΜ·Θ§Τδ÷–«ζœΏbΕ‘”ΠΒΡ «―ΈΥα
±μ ΨΒ»pHΒΡ―ΈΥα”κ¥ΉΥα÷–Ζ÷±πΦ”Υ°œΓ ΆΒΡpH±δΜ·Θ§Τδ÷–«ζœΏbΕ‘”ΠΒΡ «―ΈΥα
D.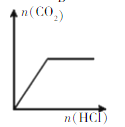 ±μ Ψœρ
±μ Ψœρ![]() »ή“Κ÷–÷πΒΈΦ”œΓ―ΈΥαΘ§…ζ≥…
»ή“Κ÷–÷πΒΈΦ”œΓ―ΈΥαΘ§…ζ≥…![]() ”κΥυΦΉ―ΈΥαΈο÷ ΒΡΝΩΒΡΙΊœΒ
”κΥυΦΉ―ΈΥαΈο÷ ΒΡΝΩΒΡΙΊœΒ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com