
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
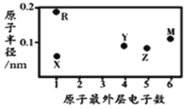
A.简单阳离子半径X最小
B.M的氢化物常温常压下为气体,分子间无氢键
C.最高价氧化物的水化物的酸性:Z<Y
D.X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请完成该实验中的问题:
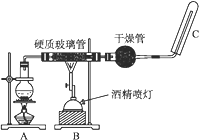
(1)该氧化还原反应的还原剂是____,氧化剂是____。
(2)实验前必须对整套装置进行气密性检查,操作方法是______________。
(3)干燥管中盛装的物质的作用是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图装置中的叙述正确的是
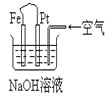
A.这是电解NaOH溶液的装置
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色
C.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu,则下列说法正确的是
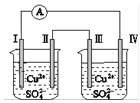
A.电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ
B.电极Ⅰ发生还原反应
C.电极Ⅳ逐渐溶解
D.电极Ⅲ的电极反应:Cu-2e-===Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)
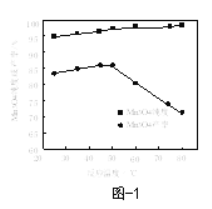
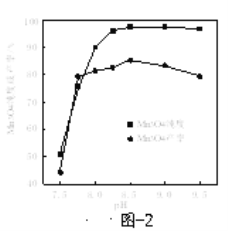
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
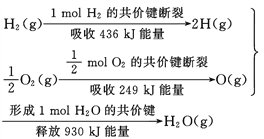
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份Fe2(SO4)3和(NH4)2SO4的混合溶液,向该溶液中加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液的体积关系如图。

(1)Ba(OH)2溶液的物质的量浓度为___________mol·L-1。
(2)该混合溶液中Fe2(SO4)3和(NH4)2SO4物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0. 25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=267 kJ·mol-1
N2(g)+H2O(g) ΔH=267 kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=534 kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L盐酸或NaOH溶液滴定体积均为20 mL,浓度均为0.1mol/L的MOH、HX溶液,滴定曲线如图所示。下列说法错误的是

A.两个滴定实验均可用酚酞作指示剂
B.常温下0.1mol/LMX溶液的pH<7
C.a点溶液中存在:c(X-)>c(HX)
D.b点溶液中存在:2c(MOH)+c(M+)+c(OH-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com