
【题目】某溶液Y可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验
中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验![]() 假设气体全部逸出,忽略
假设气体全部逸出,忽略![]() 分解
分解![]() 下列说法不正确的是
下列说法不正确的是![]()

A.溶液Y中一定不存在![]() 、
、![]()
B.溶液Y中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.溶液Y中一定存在![]() ,且
,且![]()
D.溶液Y中可能存在![]() ,为了确定是否存在,可取溶液通过焰色反应验证
,为了确定是否存在,可取溶液通过焰色反应验证
【答案】C
【解析】
由实验可知,加足量的![]() ,可氧化
,可氧化![]() ,酸化得到的气体1为二氧化碳,则一定含
,酸化得到的气体1为二氧化碳,则一定含![]() ,沉淀
,沉淀![]() 为
为![]() ,则原溶液中一定含
,则原溶液中一定含![]() ,原溶液中一定不含
,原溶液中一定不含![]() ,且一定含
,且一定含![]() ,由离子共存可知一定不含
,由离子共存可知一定不含![]() ;溶液1中加过量氢氧化钡溶液、加热生成的气体2为氨气,则原溶液一定含
;溶液1中加过量氢氧化钡溶液、加热生成的气体2为氨气,则原溶液一定含![]() ,由题可知溶液Y中阳离子浓度相同,则
,由题可知溶液Y中阳离子浓度相同,则![]() ,加入过量氢氧化钡溶液不再生成沉淀,则溶液1中无
,加入过量氢氧化钡溶液不再生成沉淀,则溶液1中无![]() ,所以由硫原子守恒知
,所以由硫原子守恒知![]() ,根据电荷守恒知溶液Y中一定含
,根据电荷守恒知溶液Y中一定含![]() ,不能确定原溶液中是否含
,不能确定原溶液中是否含![]() 。
。
由上述分析可知,原溶液中一定含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,一定不含
,一定不含![]() 、
、![]() ,不能确定原溶液中是否含
,不能确定原溶液中是否含![]() 。
。
A. 溶液Y中一定不存在![]() 、
、![]() ,选项A正确;
,选项A正确;
B. 溶液Y中肯定存在![]() 、
、![]() 、
、![]() 、
、![]() ,选项B正确;
,选项B正确;
C. 溶液Y中一定存在![]() ,但若存在
,但若存在![]() ,则
,则![]() ,选项C不正确;
,选项C不正确;
D. 溶液Y中可能存在![]() ,为了确定是否存在,可取溶液通过焰色反应验证,选项D正确。
,为了确定是否存在,可取溶液通过焰色反应验证,选项D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
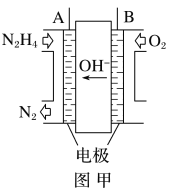
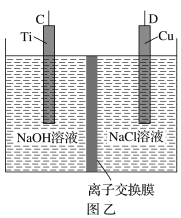
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________,
肼燃料电池中A极发生的电极反应为____________________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:[C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
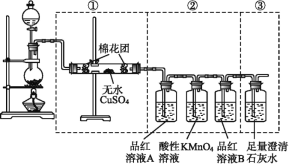
(1)②中酸性KMnO4溶液的作用是____________。
(2)②中两次用到品红溶液,它们的作用分别是A______,B_____。
(3)③中出现的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
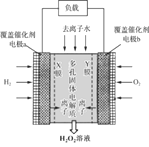
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10B.9:1C.4:1D.4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的有( )
①C(s)+O2(g)═CO2(g) △H1 C(s)+![]() O2(g)═CO(g) △H2
O2(g)═CO(g) △H2
②S(s)+O2(g)═SO2(g) △H3 S(g)+O2(g)═SO2(g) △H4
③2H2(g)+O2(g)═2H2O(l) △H5 2H2(g)+O2(g)═2H2O(g) △H6
④CaCO3(s)═CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)═Ca(OH)2(s) △H8
⑤![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
⑥N2O4(g)![]() 2NO2(g) △H11 2NO2(g)
2NO2(g) △H11 2NO2(g)![]() N2O4(g) △H12
N2O4(g) △H12
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来
B.合成氨工业用铁触媒作催化剂
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
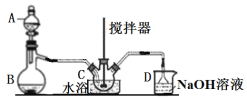
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与![]() 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得![]()
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量![]() 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒沙特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业合成氨时选择高温能极大加快反应速率
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com