
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
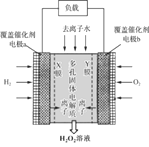
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式 ______ ;
表示的分子式 ______ ;
(2)CH3CH(C2H5)C(CH3)2CH2CH3的名称是 _____________________________;
(3)写出结构简式:3,3-二甲基-4-乙基庚烷 ____________________________;
(4)相对分子质量为70的单烯烃的分子式为 ___________,若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式有 ______种(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是生活中常见的物质,请回答下列问题:
是生活中常见的物质,请回答下列问题:
(1)写出![]() 在水溶液中电离的方程式:______________。
在水溶液中电离的方程式:______________。
(2)![]() 属于“酸”“碱”“盐”中的________________________。
属于“酸”“碱”“盐”中的________________________。
(3)①写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:___________________________。
溶液反应的离子方程式:___________________________。
②写出![]() 溶液与
溶液与![]() 溶液反应的离子方程式:_____________________________________。
溶液反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___。
(2)判断滴定终点的现象是___。
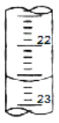
(3)如图是某次滴定时滴定管中的液面,其读数为__mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
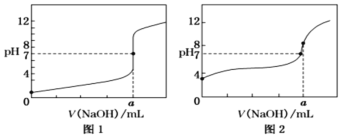
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___(填“图1”或“图2”)。
②a=___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
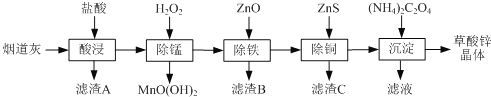
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣B的主要成分为________ 。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为___________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是________。
(4)若沉淀过程采用Na2C2O4代替草酸铵晶体生产草酸锌,合理的加料方式是________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为________。
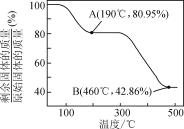
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵![]() 又称莫尔盐,是浅绿色晶体。用硫铁矿
又称莫尔盐,是浅绿色晶体。用硫铁矿![]() 主要含
主要含![]() 、
、![]() 等
等![]() 制备莫尔盐的流程如下:
制备莫尔盐的流程如下:
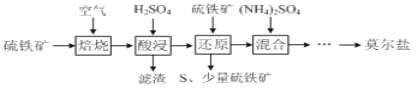
已知:“还原”时,![]() 与
与![]() 不反应,
不反应,![]() 通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:![]()
![]() 写出“还原”时
写出“还原”时![]() 与
与![]() 发生还原反应Ⅱ的离子方程式:__________。
发生还原反应Ⅱ的离子方程式:__________。
实验室检验“还原”已完全的方法是__________。
![]() “还原”前后溶液中部分离子的浓度见下表
“还原”前后溶液中部分离子的浓度见下表![]() 溶液体积变化忽略不计
溶液体积变化忽略不计![]() ,请计算反应Ⅰ、Ⅱ中被还原的Fe
,请计算反应Ⅰ、Ⅱ中被还原的Fe![]() 的物质的量之比__________。
的物质的量之比__________。
离子 | 离子浓度 | |
还原前 | 还原后 | |
|
|
|
|
|
|
![]() 称取
称取![]() 新制莫尔盐,溶于水配成250mL溶液。取
新制莫尔盐,溶于水配成250mL溶液。取![]() 该溶液加入足量的
该溶液加入足量的![]() 溶液,得到白色沉淀
溶液,得到白色沉淀![]() ;另取
;另取![]() 该溶液用
该溶液用![]() 酸性溶液滴定,当
酸性溶液滴定,当![]() 恰好完全被还原为
恰好完全被还原为![]() 时,消耗溶液的体积为
时,消耗溶液的体积为![]() 。试确定莫尔盐的化学式
。试确定莫尔盐的化学式![]() 请写出计算过程)________________。
请写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液Y可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验
中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验![]() 假设气体全部逸出,忽略
假设气体全部逸出,忽略![]() 分解
分解![]() 下列说法不正确的是
下列说法不正确的是![]()

A.溶液Y中一定不存在![]() 、
、![]()
B.溶液Y中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.溶液Y中一定存在![]() ,且
,且![]()
D.溶液Y中可能存在![]() ,为了确定是否存在,可取溶液通过焰色反应验证
,为了确定是否存在,可取溶液通过焰色反应验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
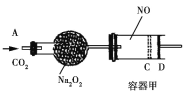
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法错误的是
ZnO+2Ni(OH)2。下列说法错误的是

A.放电过程中OH通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OHe=NiOOH+H2O
C.放电时负极反应为Zn+2OH2e=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com