
【题目】硫酸亚铁铵![]() 又称莫尔盐,是浅绿色晶体。用硫铁矿
又称莫尔盐,是浅绿色晶体。用硫铁矿![]() 主要含
主要含![]() 、
、![]() 等
等![]() 制备莫尔盐的流程如下:
制备莫尔盐的流程如下:
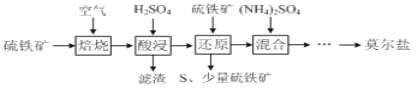
已知:“还原”时,![]() 与
与![]() 不反应,
不反应,![]() 通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:![]()
![]() 写出“还原”时
写出“还原”时![]() 与
与![]() 发生还原反应Ⅱ的离子方程式:__________。
发生还原反应Ⅱ的离子方程式:__________。
实验室检验“还原”已完全的方法是__________。
![]() “还原”前后溶液中部分离子的浓度见下表
“还原”前后溶液中部分离子的浓度见下表![]() 溶液体积变化忽略不计
溶液体积变化忽略不计![]() ,请计算反应Ⅰ、Ⅱ中被还原的Fe
,请计算反应Ⅰ、Ⅱ中被还原的Fe![]() 的物质的量之比__________。
的物质的量之比__________。
离子 | 离子浓度 | |
还原前 | 还原后 | |
|
|
|
|
|
|
![]() 称取
称取![]() 新制莫尔盐,溶于水配成250mL溶液。取
新制莫尔盐,溶于水配成250mL溶液。取![]() 该溶液加入足量的
该溶液加入足量的![]() 溶液,得到白色沉淀
溶液,得到白色沉淀![]() ;另取
;另取![]() 该溶液用
该溶液用![]() 酸性溶液滴定,当
酸性溶液滴定,当![]() 恰好完全被还原为
恰好完全被还原为![]() 时,消耗溶液的体积为
时,消耗溶液的体积为![]() 。试确定莫尔盐的化学式
。试确定莫尔盐的化学式![]() 请写出计算过程)________________。
请写出计算过程)________________。
【答案】![]()
![]() 取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全
取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全 ![]()
![]() 或
或 ![]() 。
。
【解析】
![]() 酸浸后的溶液中含有
酸浸后的溶液中含有![]() ,与硫铁矿反应,生成
,与硫铁矿反应,生成![]() ,硫元素被氧化为硫单质;如果
,硫元素被氧化为硫单质;如果![]() 还原完全,则加入KSCN,溶液不变红,如果溶液变红则“还原”未完全;
还原完全,则加入KSCN,溶液不变红,如果溶液变红则“还原”未完全;
![]() 则Ⅰ、Ⅱ中被还原的
则Ⅰ、Ⅱ中被还原的![]() 的物质的量之比
的物质的量之比![]() :
:![]() ;
;
![]() 依据电子转移守恒、电荷守恒、质量守恒进行计算。
依据电子转移守恒、电荷守恒、质量守恒进行计算。
![]() 酸浸后的溶液中含有
酸浸后的溶液中含有![]() ,与硫铁矿反应,生成
,与硫铁矿反应,生成![]() ,硫元素被氧化为硫单质,则化学方程式为:
,硫元素被氧化为硫单质,则化学方程式为:![]()
![]() ,如果
,如果![]() 还原完全,则加入KSCN,溶液不变红,则检验方法为:取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全,故答案为:
还原完全,则加入KSCN,溶液不变红,则检验方法为:取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全,故答案为:![]()
![]() ;取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全;
;取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全;
![]() 还原前后硫酸根浓度变化量
还原前后硫酸根浓度变化量![]() ,由反应I的方程式可知被还原的
,由反应I的方程式可知被还原的![]() 的物质的量浓度为
的物质的量浓度为![]() ,同时生成
,同时生成![]() ,从表中可知亚铁离子浓度变化为
,从表中可知亚铁离子浓度变化为![]() ,则II中被还原的
,则II中被还原的![]() 的物质的量浓度为
的物质的量浓度为![]() ,则Ⅰ、Ⅱ中被还原的
,则Ⅰ、Ⅱ中被还原的![]() 的物质的量之比
的物质的量之比![]() :
:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 原样品中n(SO42-)=
原样品中n(SO42-)=![]() =0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为:
=0.06mol,n(MnO4-)=0.0200mol/L×0.03L=0.0006mol,由得失电子守恒可知:n(Fe2+)=5n(MnO4-)=0.003mol,原样品中n(Fe2+)=0.03 mol,由电荷守恒可知:原样品中n(NH4+)=0.06mol,由质量守恒得:n(H2O)=0.18mol,得出化学式为: ![]() 或
或 ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界____。
(2)表中最活泼的金属与最活泼的非金属形成的物质是___(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:___,这两种化合物中所含的化学键有____(填字母)。
A.极性共价键 B.非极性共价键 C.离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为____(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为____(填离子符号)。
(6)d、e、m、p的气态氢化物中,最不稳定的是(填分子式)____。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验对应描述及结论正确的是

A.上下移动图①左侧量气管,两侧液面保持等高,证明气密性良好
B.图②可以防止倒吸,能用作某些反应的安全瓶
C.图③可以用来制取并收集少量氨气
D.量取10.00mL液体时,起始时平视读数,终点时如图④所示读数,量取液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂为同一种物质的是
A.SO2+2H2S=3S↓+H2B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑D.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
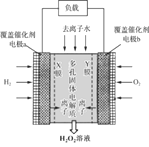
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示
盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示![]() 因逸出未画出,滴加盐酸的过程中温度的变化忽略不计
因逸出未画出,滴加盐酸的过程中温度的变化忽略不计![]() 。下列说法正确的是
。下列说法正确的是![]()
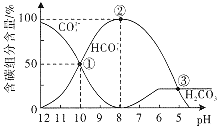
A.点![]() 时溶液中水的电离程度比纯水的大
时溶液中水的电离程度比纯水的大
B.点![]() 所示溶液中:
所示溶液中:![]()
C.当滴加盐酸到点![]() 时,才开始放出
时,才开始放出![]() 气体
气体
D.![]() 第一步水解反应的平衡常数:
第一步水解反应的平衡常数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的有( )
①C(s)+O2(g)═CO2(g) △H1 C(s)+![]() O2(g)═CO(g) △H2
O2(g)═CO(g) △H2
②S(s)+O2(g)═SO2(g) △H3 S(g)+O2(g)═SO2(g) △H4
③2H2(g)+O2(g)═2H2O(l) △H5 2H2(g)+O2(g)═2H2O(g) △H6
④CaCO3(s)═CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)═Ca(OH)2(s) △H8
⑤![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
⑥N2O4(g)![]() 2NO2(g) △H11 2NO2(g)
2NO2(g) △H11 2NO2(g)![]() N2O4(g) △H12
N2O4(g) △H12
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________,其第一电离能比Be___________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________,写出[BH4]-的一种阳离子等电子体_______。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________。

(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________。
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量的计算式是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
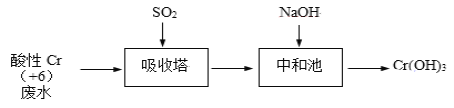
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
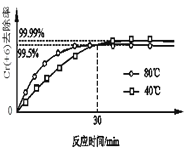
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com