
����Ŀ��������Ԫ�����ڱ��IJ�ͼ������������ĸ���ŷֱ����ijһ��Ԫ�أ���ش�

��1�����е�ʵ�߱�ʾԪ�����ڱ������ұ߽磬����ʵ�߲�ȫԪ�����ڱ������±߽�____��
��2����������õĽ���������õķǽ����γɵ�������___(�ѧʽ)��
��3����a��d����Ԫ�ؿ��γ����ֻ����д������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽ��___�������ֻ������������Ļ�ѧ����____(����ĸ)��
A.���Թ��ۼ� B.�Ǽ��Թ��ۼ� C.���Ӽ�
��4��e��f��k��m��Ӧ�ĵ�ԭ�����ӵİ뾶�ɴ�С��˳��Ϊ____(�����ӷ���)��
��5��d��m��Ӧ�����ӻ�ԭ����ǿ����˳��Ϊ____(�����ӷ���)��
��6��d��e��m��p����̬�⻯���У���ȶ�����(�����ʽ)____��
��7���õ���ʽ��ʾn��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������γɹ��̣�____��
���𰸡�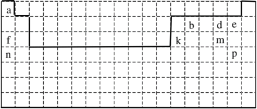 �� KF�� 2H2O2=2H2O+O2���� AB�� S2- >F-> Na+>Al3+�� S2- >O2-�� HBr��
�� KF�� 2H2O2=2H2O+O2���� AB�� S2- >F-> Na+>Al3+�� S2- >O2-�� HBr�� ![]() ��
��
��������
��1��Ԫ�����ڱ����߸����ڣ���һ���ڰ���2��Ԫ�أ��ڶ���������Ϊ�����ڰ���8��Ԫ�أ���������Ϊ�����ڣ���Ԫ�����ڱ����±�����ͼ��ʾ��
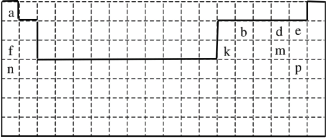
��2����������õĽ���������õķǽ����ֱ�ΪK��F�����γɵ�������KF��
��3����a��d����Ԫ�طֱ�ΪH��O�����γ����ֻ�����ΪH2O��H2O2��������һ�ֻ�����ֽ�������һ�ֻ�����Ļ�ѧ����ʽΪ��2H2O2=2H2O+O2���������ֻ������������Ļ�ѧ���м��Թ��ۼ��ͷǼ��Թ��ۼ�����ѡAB��
��4��e��f��k��m��Ӧ�ĵ�ԭ�����ӷֱ�ΪF-��Na+��Al3+��S2-����뾶�ɴ�С��˳��ΪS2- >F-> Na+>Al3+��
��5��d��m��Ӧ�����ӷֱ�ΪO2-��S2-����ԭ����ǿ����˳��ΪS2- >O2-��
��6��d��e��m��p����̬�⻯���У���ȶ�����HBr��
��7��n��m�γɵ�ԭ�Ӹ�����2��1�Ļ�������K2S�������ʽ��ʾ�γɹ���Ϊ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦPbS��O2 ![]() Pb��SO2��
Pb��SO2��
��1���뽫������Ӧ�õ����ŷ��������ת�Ƶķ������Ŀ��________________________________________
��2��������Ӧ���������� _________________����ԭ����_______________������������________________����ԭ������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���ˮ�д��ڵ���ƽ��D2O![]() D++OD����D2O�����ӻ�����Ϊ1.0��10��12����pD=��lg c(D+)�����¶����йط�������ȷ���ǣ�������
D++OD����D2O�����ӻ�����Ϊ1.0��10��12����pD=��lg c(D+)�����¶����йط�������ȷ���ǣ�������
A.0.1 mol NaOD������ˮ�Ƴ�1 L��Һ��pD=13
B.��pD=4��DCl����ˮ��Һϡ��100����������ҺpD������6
C.��30 mL0.5 mol/L NaOD����ˮ��Һ�м���20 mL 0.5 mol/L DCl����ˮ��Һ��������ҺpD = 11
D.pD = 10��NaOD����ˮ��Һ�У�����ˮ�������c��OD����Ϊ1��10��10mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����l0mL0.01mol��L-1NaA��Һ����μ���0.01mol��L-1�����ᣬ�ζ���������ͼ��ʾ������˵����ȷ���ǣ� ��

A. a�㵽c��Ĺ����У�c(HA)+c(A-)=0.01mol��L-1��ʽʼ�ճ���
B. b��ʱ����Һ����Ũ�ȴ�С�Ĺ�ϵ��c(A-)>c(Cl-)>c(HA)>c(OH-)>c(H+)
C. c����Һ���ڵĹ�ϵ��c(Na+)+c(H+)=c(HA)+c(OH-)+2c(A-)
D. ��ͼ��֪����Ũ�ȵ�HA��NaA�����Һ�У�HA�ĵ���̶ȴ���A-��ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʽ![]() ��ʾ�ķ���ʽ ______ ��
��ʾ�ķ���ʽ ______ ��
��2��CH3CH��C2H5��C��CH3��2CH2CH3�������� _____________________________��
��3��д���ṹ��ʽ��3��3-����-4-�һ����� ____________________________��
��4����Է�������Ϊ70�ĵ�ϩ���ķ���ʽΪ ___________������ϩ��������H2�ӳɺ������ɺ�3���������������ϩ�����ܵĽṹ��ʽ�� ______�֣�������˳���칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������״̬�ܵ��������һ�������ӻ�����
B.CO2��CS2ÿ��ԭ�ӵ�����㶼����8�����ȶ��ṹ
C.�ɱ���ʯӢ�����еĻ�ѧ��������ͬ���ۻ�ʱ��˷����������������Ҳ��ͬ
D.2016��IUPAC����117��Ԫ��ΪTs��Ts��ԭ�Ӻ���������������7���ǵ������ڵڢ�B��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Һ���ܺ��������������е�һ�ֻ��֣�![]() ��
��![]() ��Cl��
��Cl��
(1)����Һ���д���H+����ʱ��������________���ڡ�
(2)����Һ���д���Ba2+����ʱ����Һ�в�������________���ڡ�
(3)����Һ����________��________�������Ӵ���ʱ���������������Ӷ������ܴ��ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С����������洢װ�õ��ŵ㡣һ������(N2H4)Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ������������������Ϊ����ʡ����й��ڸ�ȼ�ϵ�ص���������ȷ���ǣ� ��
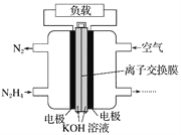
A.�������Ҳ�缫�������غ��������缫
B.���������ĵ缫��ӦʽΪ��N2H4��4OH--4e-=N2����4H2O
C.��ȼ�ϵ�صĵ缫����Ӧ���ö������ϣ�����ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�
D.��ȼ�ϵ�س����ŵ�ʱ�������ӴӸ���������Ǩ�ƣ���ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������![]() �ֳ�Ī���Σ���dz��ɫ���塣��������
�ֳ�Ī���Σ���dz��ɫ���塣��������![]() ��Ҫ��
��Ҫ��![]() ��
��![]() ��
��![]() �Ʊ�Ī���ε��������£�
�Ʊ�Ī���ε��������£�
��֪������ԭ��ʱ��![]() ��
��![]() ����Ӧ��
����Ӧ��![]() ͨ����Ӧ��ԭ����Ӧ�����£�
ͨ����Ӧ��ԭ����Ӧ�����£�![]()
![]() д������ԭ��ʱ
д������ԭ��ʱ![]() ��
��![]() ������ԭ��Ӧ������ӷ���ʽ��__________��
������ԭ��Ӧ������ӷ���ʽ��__________��
ʵ���Ҽ�������ԭ������ȫ�ķ�����__________��
![]() ����ԭ��ǰ����Һ�в������ӵ�Ũ�ȼ��±�
����ԭ��ǰ����Һ�в������ӵ�Ũ�ȼ��±�![]() ��Һ����仯���Բ���
��Һ����仯���Բ���![]() ������㷴Ӧ���б���ԭ��Fe
������㷴Ӧ���б���ԭ��Fe![]() �����ʵ���֮��__________��
�����ʵ���֮��__________��
���� | ����Ũ�� | |
��ԭǰ | ��ԭ�� | |
|
|
|
|
|
|
![]() ��ȡ
��ȡ![]() ����Ī���Σ�����ˮ���250mL��Һ��ȡ
����Ī���Σ�����ˮ���250mL��Һ��ȡ![]() ����Һ����������
����Һ����������![]() ��Һ���õ���ɫ����
��Һ���õ���ɫ����![]() ����ȡ
����ȡ![]() ����Һ��
����Һ��![]() ������Һ�ζ�����
������Һ�ζ�����![]() ǡ����ȫ����ԭΪ
ǡ����ȫ����ԭΪ![]() ʱ��������Һ�����Ϊ
ʱ��������Һ�����Ϊ![]() ����ȷ��Ī���εĻ�ѧʽ
����ȷ��Ī���εĻ�ѧʽ![]() ��д���������)________________��
����������)________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com