
【题目】某学生用0.10mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号)___。
(2)判断滴定终点的现象是___。
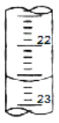
(3)如图是某次滴定时滴定管中的液面,其读数为__mL。
(4)根据下列数据:请计算待测盐酸溶液的物质的量浓度c(HCl)=___mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)若测定结果偏高,其原因可能是___。
A.在配制0.10mol/LNaOH标准溶液定容时,俯视容量瓶刻度线
B.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
C.滴定终点读数时,仰视滴定管的刻度
D.步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡
(6)某同学用0.10mol/LNaOH标准溶液分别滴定20.00mL0.10mol/L的HCl溶液和20.00mL0.10mol/L的CH3COOH溶液,得到如图所示的两条滴定曲线:
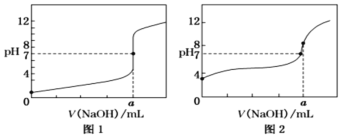
①用0.10mol/L的NaOH标准溶液滴定20.00mL0.10mol/L的CH3COOH溶液的曲线是___(填“图1”或“图2”)。
②a=___mL。
【答案】 ① 当滴入最后一滴NaOH标准液,溶液由无色变为浅红色,且30s内不褪色 22.60 0.10 BC 图2 20.00
【解析】
(1)根据中和滴定的原理及操作规则进行分析;
(2)酚酞遇碱变红,据此现象判定滴定终点;
(3)滴定管的0刻度在滴定管的顶部,滴定管的读数精确到0.01mL,据此读数;
(4)根据实验消耗NaOH的体积求出平均值(注意误差较大的应舍弃)根据c(HCl)×V(HCl)=c(NaOH)×V(NaOH),计算![]() ;
;
(5)根据![]() 分析误差;
分析误差;
(6)①根据滴定图像及盐酸和醋酸的强弱即可判定NaOH溶液滴定CH3COOH溶液的曲线图;
②根据图1,当加入NaOH溶液的体积为amL时,溶液的pH=7,说明恰好反应,NaOH与HCl生成NaCl,溶液呈中性,则根据c(HCl)×V(HCl)=c(NaOH)×V(NaOH),可计算出a。
(1)①蒸馏水洗涤碱式滴定管后,应该用NaOH溶液润洗,而不是立即注入NaOH溶液,否则会稀释NaOH溶液,造成标准液消耗偏多,①错误;
②固定好滴定管并使滴定管尖嘴处充满液体,滴定管中充满液体,读数才准确,②准确;
③滴定时,通过开始和结束的读数的差值求算消耗标准液的体积,0刻度在滴定管的顶部,因此开始的读数,应调节液面到0刻度和0刻度以下,③正确;
④该反应为强碱滴定强酸,滴定终点为中性,可以选择酚酞作指示剂,④正确;
⑤到达滴定终点时,记录数据,⑤正确;
答案为①;
(2)锥形瓶中盛装盐酸,滴入酚酞为无色,滴入NaOH标准液,当滴入最后一定NaOH标准液时,溶液由无色变为浅红色,且半分钟内不褪色,达到滴定终点;
(3)滴定管的0刻度在滴定管的顶部,读数时应该从上看到下,滴定管的读数精确到0.01mL,则该读数为22.60mL;
(4)三组实验消耗NaOH的体积分别为20.00mL、22.10mL、20.00mL,第二次实验的数据明显偏大,应舍弃,则消耗NaOH的体积为![]() 。根据c(HCl)×V(HCl)=c(NaOH)×V(NaOH),有
。根据c(HCl)×V(HCl)=c(NaOH)×V(NaOH),有![]() ;
;
(5)根据![]() 分析误差;
分析误差;
A.在配制NaOH标准液定容时,俯视容量瓶刻度线,造成NaOH标准液浓度偏大,滴定时消耗的NaOH标准的体积偏小,使得c(HCl)的测定结果偏小,A不符合题意;
B.用未知液润洗锥形瓶,滴定时消耗的NaOH标准液的体积偏大,使得c(HCl)的测定结果偏高,B符合题意;
C.滴定终点读数时,仰视滴定管的刻度,则读到的消耗的NaOH标准液的体积偏大,求得c(HCl)的测定结果偏高,C符合题意;
D.滴定终点读数时,尖嘴有气泡,气泡会占据部分液体的体积,使得读到的消耗的NaOH标准液的体积偏小,求得c(HCl)的测定结果偏低,D不符合题意;
答案选BC;
(6)①0.1mol·L-1HCl溶液的pH小于0.1mol·L-1CH3COOH溶液的pH,比较滴定前溶液的pH,可知图2是NaOH溶液滴定CH3COOH溶液的曲线图;
②根据图1,当加入NaOH溶液的体积为amL时,溶液的pH=7,说明恰好反应,NaOH与HCl生成NaCl,溶液呈中性,则根据c(HCl)×V(HCl)=c(NaOH)×V(NaOH),可得a=20.00mL。


科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
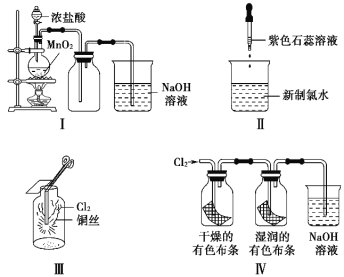
A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将两块未擦去氧化膜的铝片分别投入1mol·L-1CuSO4溶液和1mol·L-1CuCl2溶液中,铝片表面都观察不到明显的反应现象
B.溶液酸碱性对H2O2的稳定性有较大影响,在酸性溶液中,H2O2分解较快
C.Fe3+能与硫氰化钾反应生成可溶于水的血红色配合物
D.变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验对应描述及结论正确的是

A.上下移动图①左侧量气管,两侧液面保持等高,证明气密性良好
B.图②可以防止倒吸,能用作某些反应的安全瓶
C.图③可以用来制取并收集少量氨气
D.量取10.00mL液体时,起始时平视读数,终点时如图④所示读数,量取液体体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应:[C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
CO2↑+2SO2↑+2H2O] 产生的所有气体产物,选用了如图所示实验装置。
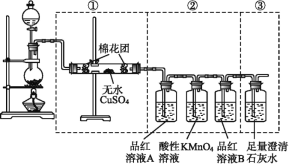
(1)②中酸性KMnO4溶液的作用是____________。
(2)②中两次用到品红溶液,它们的作用分别是A______,B_____。
(3)③中出现的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂为同一种物质的是
A.SO2+2H2S=3S↓+H2B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑D.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
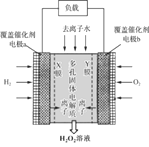
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的有( )
①C(s)+O2(g)═CO2(g) △H1 C(s)+![]() O2(g)═CO(g) △H2
O2(g)═CO(g) △H2
②S(s)+O2(g)═SO2(g) △H3 S(g)+O2(g)═SO2(g) △H4
③2H2(g)+O2(g)═2H2O(l) △H5 2H2(g)+O2(g)═2H2O(g) △H6
④CaCO3(s)═CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)═Ca(OH)2(s) △H8
⑤![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
Na2SO4(aq)+H2O(l) ΔH9CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH10
⑥N2O4(g)![]() 2NO2(g) △H11 2NO2(g)
2NO2(g) △H11 2NO2(g)![]() N2O4(g) △H12
N2O4(g) △H12
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较氧化性相对强弱:Cl2_______I2(填“)”>“<”或“=”);用一个离子方程式说明Cl2和I2氧化性的相对强弱_______。
(2)NH5是离子化合物,各原子最外层满足稳定结构。写出NH5的电子式__________。
(3)请用系统命名法对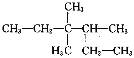 命名__________。
命名__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com