
【题目】下列生产、生活等实际应用,不能用勒沙特列原理解释的是( )
A.冰镇的啤酒打开后泛起泡沫
B.实验室中常用排饱和食盐水的方法收集Cl2
C.工业合成氨时选择高温能极大加快反应速率
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
【答案】C
【解析】
A、啤酒中存在二氧化碳的溶解平衡,开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强减小,二氧化碳逸出,能用勒沙特列原理解释,故A不选;
B、存在氯气和水反应生成盐酸和次氯酸的平衡,饱和食盐水中氯离子浓度较大,使得平衡逆向移动,减小了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,故B不选;
C、工业合成氨的反应为放热反应,高温不利于提高氨气的产率,主要是选择铁做催化剂在高温下,催化剂的活性较高,不能用勒沙特列原理解释,故C选;
D、存在平衡2SO2+O2 ![]() 2SO3,使用过量的空气,可以增大氧气的浓度,可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故D不选;
2SO3,使用过量的空气,可以增大氧气的浓度,可以使化学平衡正向移动,提高SO2的利用率,能用勒沙特列原理解释,故D不选;
故选C。


科目:高中化学 来源: 题型:
【题目】某溶液Y可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验
中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验![]() 假设气体全部逸出,忽略
假设气体全部逸出,忽略![]() 分解
分解![]() 下列说法不正确的是
下列说法不正确的是![]()

A.溶液Y中一定不存在![]() 、
、![]()
B.溶液Y中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.溶液Y中一定存在![]() ,且
,且![]()
D.溶液Y中可能存在![]() ,为了确定是否存在,可取溶液通过焰色反应验证
,为了确定是否存在,可取溶液通过焰色反应验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C.SO2通入BaCl2溶液有白色沉淀BaSO3生成
D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法错误的是
ZnO+2Ni(OH)2。下列说法错误的是

A.放电过程中OH通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OHe=NiOOH+H2O
C.放电时负极反应为Zn+2OH2e=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某无色溶液用激光笔照射无丁达尔现象,加入FeCl3后溶液显色.下列各组微粒在此溶液可以大量共存的是
A.Na+、K+、Fe2+、Cl-
B.K+、Fe2+、NO3-、Fe(OH)3(胶体)
C.Cl-、SCN-、NH4+、葡萄糖分子
D.OH-、Na+、苯酚、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(s)+3B(g)![]() 2C(g) ΔH<0,下列叙述正确的是( )
2C(g) ΔH<0,下列叙述正确的是( )
A.升高温度,v(逆)增大,v(正)减小
B.增大压强,v(正)增大,v(逆)减小
C.增大A的物质的量,v(正)增大,v(逆)减小
D.采用催化剂,降低反应活化能,v(正)、v(逆)同时增大,且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1 g镁铝合金溶于60 mL 5.0mol·L![]() H
H![]() SO
SO![]() 溶液中,完全溶解后再加入a mL10.0 mol·L
溶液中,完全溶解后再加入a mL10.0 mol·L![]() 的NaOH溶液,此时溶液中的Mg
的NaOH溶液,此时溶液中的Mg![]() 、Al
、Al![]() 恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
恰好完全沉淀,再继续滴加5 mL该NaOH溶液,得到的沉淀质量为9.7 g。
(1)当加入a=_________mLNaOH溶液时,可使溶液中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。沉淀的最大值为__________ g。
恰好完全沉淀。沉淀的最大值为__________ g。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积___________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.![]() 点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
C.![]() 点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2 ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
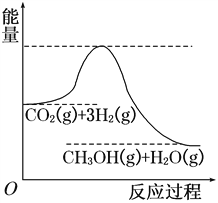
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
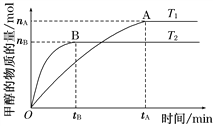
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com