
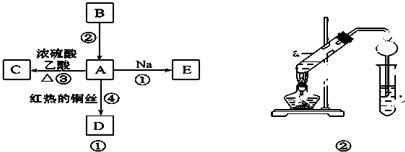
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
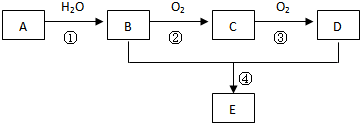
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定后酸式滴定管尖嘴处悬有一滴液体 |
| B、酸式滴定管洗净后,没有用标准盐酸润洗,直接装标准盐酸滴定碱液 |
| C、滴定前,酸式滴定管有气泡,滴定后消失 |
| D、记录所用盐酸体积时,先仰视读数,终点时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过电解熔融的Z、Q形成的化合物可制取Z单质 |
| B、原子半径的大小顺序为W>Q>Z>X>Y |
| C、元素Y的最高正化合价为+6 |
| D、XQ3分子中,中心原子是sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
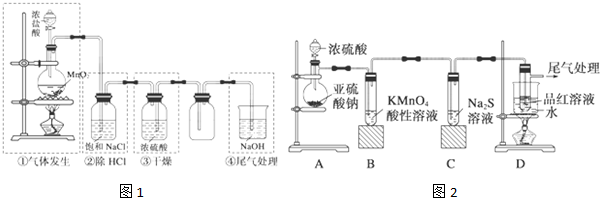
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com