
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为______;t2时刻,正逆反应速率大小:v正 ____v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
【答案】25% ![]() 7:10 2N(g)
7:10 2N(g)![]() M(g) > BD 946
M(g) > BD 946
【解析】
根据图像分析,从反应开始到平衡M、N的物质的量变化量分别为3mol、6mol,得出反应方程式为2N(g)![]() M(g)。
M(g)。
(1)t1时刻N的物质的量为6mol,N起始的物质的量为8mol,其转化率为![]() 。
。
(2)0~t3时间内用M表示的化学反应速率![]() 。
。
(3)恒温恒容的密闭容器中,压强之比等于气体分子的物质的量之比,则平衡时容器内气体的压强与起始时容器内压强的比值为7:10。
(4)综上分析,该反应的化学方程式为2N(g)![]() M(g);t2时刻,反应未达到平衡,此时反应继续向正向移动,正逆反应速率大小:v正>v逆。
M(g);t2时刻,反应未达到平衡,此时反应继续向正向移动,正逆反应速率大小:v正>v逆。
(5) A.当正逆反应速率相等时,反应达到平衡,根据化学计量数,2v逆(M)=v正(N)时反应达到平衡,A错误;
B.起始时M与N的物质的量之比为1:4,平衡时M与N的物质的量之比为5:2,M与N的物质的量之比由变到不变并保持不变,则反应达到平衡,B正确;
C.混合气体的质量不变,容器的体积不变,则混合气体密度一直保持不变,不能说明反应达到平衡状态,C错误;
D.该反应为反应前后气体分子数改变的反应,则容器中压强由变到保持不变,说明反应达到平衡状态,D正确;
答案选BD。
(6)合成氨反应为N2+3H2![]() 2NH3,反应放出能量=成键释放的能量-断键吸收的能量,设N≡N的键能为x kJ/mol,则2×46kJ=(391kJ/mol×6)-(x+436kJ/mol×3),求得x=946 kJ/mol,则N≡N的键能为946 kJ/mol。
2NH3,反应放出能量=成键释放的能量-断键吸收的能量,设N≡N的键能为x kJ/mol,则2×46kJ=(391kJ/mol×6)-(x+436kJ/mol×3),求得x=946 kJ/mol,则N≡N的键能为946 kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质,回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 ______ 。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 ______
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 ______ 。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 ______(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有 ______(填离子符号),反应的离子方程式为 ______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ______ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是 ______ ,生成沉淀的原因是 ______(用平衡移动原理解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)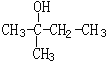 的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
(2)写出 2,3-二甲基-4-乙基已烷结构简式_________________CH3CH2CH2CHO 的键线式___________________________________________________________
(3)写出CH3CH2OH催化氧化的化学方程式:__________________CH3CH2Br制取乙醇的化学方程式:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③AlCl3 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是___,不存在化学键的是_____,离子化合物有_______
(2)由离子键和极性键构成的物质是__________
(3)N2的电子式为_____ HClO的电子式为________NH4Cl的电子式为___________
(4)用电子式表示MgF2的形成过程___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是
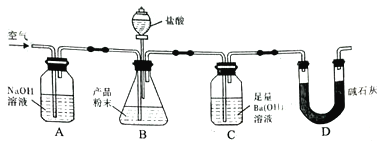
A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
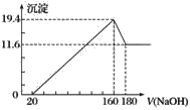
(1)合金中镁的质量是__________。
(2)所用盐酸的物质的量浓度是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理有如下两种:①CH3OH(g)+H2O(g) = CO2(g)+3H2(g)ΔH = + 49.0 kJ·mol-1②CH3OH(g)+![]() O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示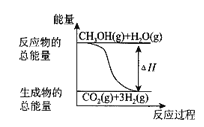
C.CH3OH转变成H2的过程一定要放出能量
D.根据②推知反应:CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应N2(g)+3H2(g)![]() 2NH3(g)达平衡的标志是( )
2NH3(g)达平衡的标志是( )
A.v正(N2)=v逆(N2)B.v正(N2)=3v正(H2)
C.v正(H2)=3v逆(NH3)D.N2、H2、NH3的体积比为1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com