
【题目】按要求回答下列问题:
(1)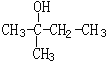 的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
的系统命名:______________________它的H-NMR谱中有________个峰,峰的面积比为___________________
(2)写出 2,3-二甲基-4-乙基已烷结构简式_________________CH3CH2CH2CHO 的键线式___________________________________________________________
(3)写出CH3CH2OH催化氧化的化学方程式:__________________CH3CH2Br制取乙醇的化学方程式:______________________
【答案】2-甲基-2-丁醇 4 6:3:2:1 CH3CH(CH3)CH(CH3)CH(CH2CH3)2 ![]() 2CH3CH2OH+O2→2CH3CHO+2H2O CH3CH2Br+NaOH→CH3CH2OH+NaBr
2CH3CH2OH+O2→2CH3CHO+2H2O CH3CH2Br+NaOH→CH3CH2OH+NaBr
【解析】
(1) 的主链为丁醇,羟基在2号碳原子,名称为:2-甲基-2-丁醇;分子中有4种氢原子,所以它的H-NMR谱中有4个峰;峰的面积比等于氢原子数之比=6:3:2:1,故答案为:2-甲基-2-丁醇;4;6:3:2:1。
的主链为丁醇,羟基在2号碳原子,名称为:2-甲基-2-丁醇;分子中有4种氢原子,所以它的H-NMR谱中有4个峰;峰的面积比等于氢原子数之比=6:3:2:1,故答案为:2-甲基-2-丁醇;4;6:3:2:1。
(2)2,3-二甲基-4-乙基已烷,最长的主链含有6个碳原子,甲基位于2、3号碳原子,乙基位于4号碳原子,其结构简式为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;CH3CH2CH2CHO中存在C=O,其键线式为:![]() ;故答案为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;
;故答案为:CH3CH(CH3)CH(CH3)CH(CH2CH3)CH2CH3;![]() 。
。
(3)CH3CH2OH在铜作催化剂条件下被氧化为乙醛,化学方程式为:2CH3CH2OH+O2→2CH3CHO+2H2O,CH3CH2Br与NaOH发生水解反应生成乙醇,化学方程式为:CH3CH2Br+NaOH→CH3CH2OH+NaBr,故答案为:2CH3CH2OH+O2→2CH3CHO+2H2O;CH3CH2Br+NaOH→CH3CH2OH+NaBr。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
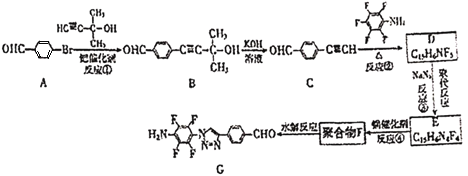
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应: 。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
。我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如图所示:
已知:
(1)化合物A的官能团是____。
(2)反应①的反应类型是____。
(3)关于B和C,下列说法正确的是____(填字母序号)。
a.利用质谱法可以鉴别B和C
b.B可以发生氧化、取代、消去反应
c.可用酸性高锰酸钾溶液检验C中含有碳碳三键
(4)B生成C的过程中还有另一种生成物X,分子式为![]() ,核磁共振氢谱显示只有一组峰,X的结构简式为____。
,核磁共振氢谱显示只有一组峰,X的结构简式为____。
(5)反应②的化学方程式为____。
(6)E的结构简式为____。
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如图,写出H、I、J的结构简式:____。
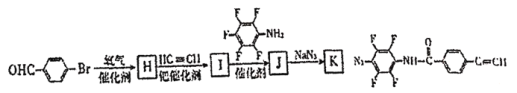
(8)聚合物F的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:
(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133 kJ/mol
H2O(g)=H2O(l) ΔH2=-44 kJ/mol
H2的燃烧热ΔH3=-285.8 kJ/mol
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为__________。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。
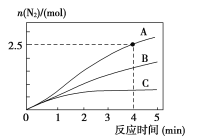
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=____。
②下列说法正确的是____。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH_____(填“增大”“减小”或“不变”),负极的电极反应式为________。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将a mol/L醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,属于同系物的是( )
A. 乙烷 , 2,2,3,3—四甲基丁烷
B. CH2=CH-COOH , CH3-CH2-CH2-COOH
C. ![]() , CH3CH2CHO
, CH3CH2CHO
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为______;t2时刻,正逆反应速率大小:v正 ____v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。

下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com