
【题目】工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5).其制备工艺流程如下:
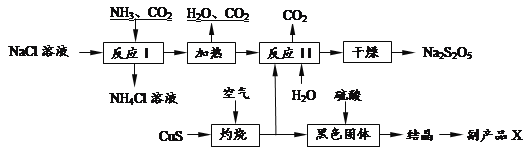
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为:_____________________________________________________ .
(2)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:__________________________.
(3)反应I时应先通的气体为______,副产品X的化学式是______.
(4)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为______.检验产品中含有碳酸钠杂质所需试剂是______(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水
④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸.
【答案】 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl S2O52-+2H+=2SO2↑+H2O NH3 CuSO45H2O 2:1 ①③⑥
【解析】反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5。硫化铜在空气中灼烧生成氧化铜和二氧化硫,氧化铜与稀硫酸反应生成硫酸铜,据此解答。
(1)根据流程可确定反应物为NaCl、NH3、CO2,产物为NH4Cl和碳酸氢钠,因此反应Ⅰ的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)根椐提示可知生成二氧化硫和水,Na2S2O5与稀硫酸反应放出SO2和水,反应的离子方程式为S2O52-+2H+=2SO2↑+H2O;
(3)由于二氧化碳在水中的溶解性很小,氨气极易溶于水,反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;根据上述分析可知,氧化铜与硫酸反应生成硫酸铜,蒸发浓缩,冷却结晶,过滤洗涤,得出硫酸铜晶体,因此副产品X的化学式是CuSO45H2O;
(4)从图示中可以看出反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:反应Ⅱ中反应应是二氧化硫与碳酸钠反应生成NaHSO3,NaHSO3再生成Na2S2O5,反应方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此气体与固体的物质的量之比为2:1;检验产品中含有碳酸钠杂质,需加酸反应检验二氧化碳生成,即用澄清石灰水,但加酸会生成二氧化硫,二氧化硫也能使澄清石灰水变浑浊,故应先除去,用酸性高锰酸钾溶液根据颜色不褪色确定二氧化硫除净,故选①③⑥。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)将一定质量的锌粒投入100mL 18.5mol/L的浓硫酸中,待锌粒完全溶解后,测得生成的H2和SO2共33.6L(标准状况),此时溶液中尚余0.1mol H+.计算可知:
①投入锌粒的质量为_____________g。
②生成的H2和SO2的物质的量之比为_____________。
(2)取25.6 g Cu与一定量的某浓度的浓HNO3反应,当铜完全溶解后,收集到产生的NO和NO2混合气体在标准状况下的体积共11.2 L,则:
①消耗硝酸的物质的量为_____________mol。
②NO的物质的量为_____________mol,NO2的物质的量为_____________mol。
③当铜完全溶解时,反应中转移的电子数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的铜绿指的是( )
A. Cu2(OH)2CO3 B. Cu(OH)2 C. CuO D. Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、Fe2O3和CuO混合物投入100 mL浓度2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,溶液中阳离子只有Fe2+,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100 mL( )
A.2 mol/L B.1.8 mol/L C.1.9 mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年1月9日,中国中医科学院青嵩家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青嵩中提取青嵩素,并设计实验测定青嵩素的分子结构。
(1)青嵩素的提取
从青嵩中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

已知:乙醚沸点为35℃。
①操作I的名称为______。
②操作III的主要过程可能是_____________。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
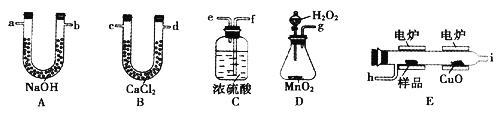
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→_______→盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是______。
③E装置中CuO的作用是_______。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为_______。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会_____(填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为_______。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶被颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与_____(填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知亚硫酸钠被氧化为硫酸钠,则铬元素在还原产物中的化合价为( )
A. +3价 B. +4价 C. +5价 D. +6价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2O4(g) ![]() 2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
2NO2(g)的焓变为ΔH。现将1mol N2O4充入一恒压密闭容器中,下列示意图能说明反应达到平衡状态的是( )
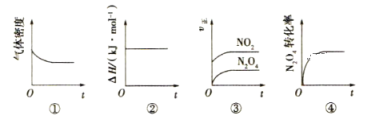
A. ①②B. ②④C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容容器中进行下列反应:N2O4(g)===2NO2(g),若N2O4的浓度由0.1 mol·L1降到0.07 mol·L1需要15 s,那么N2O4的浓度由0.07 mol·L1降到0.05 mol·L-11所需的反应时间( )
A. 等于5 sB. 等于10 s
C. 小于10 sD. 大于10 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com