
【题目】2017年1月9日,中国中医科学院青嵩家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青嵩中提取青嵩素,并设计实验测定青嵩素的分子结构。
(1)青嵩素的提取
从青嵩中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

已知:乙醚沸点为35℃。
①操作I的名称为______。
②操作III的主要过程可能是_____________。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
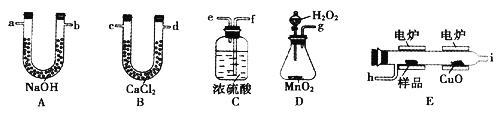
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→_______→盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是______。
③E装置中CuO的作用是_______。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为_______。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会_____(填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为_______。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶被颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与_____(填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
【答案】过滤Bdhifeab(或ba)除去氧气中的水蒸气将可能生成的CO氧化为CO2C15H22O5偏小该有机物的相对分子质量D
【解析】
本题考查的是物质的分离、提纯及物质的量有关计算,侧重学生的分析,注意把握物质的性质及分离混合物的实验操作。
(1) ①操作I是用于分离固体和液体,则可以用过滤的方法。②依据题干信息分析可知,青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶解,熔点为156~157℃,热稳定性差,乙醚的沸点为35℃,便于除去,A.青蒿素不溶于水,故错误;B. B.加95%的乙醇,浓缩、结晶、过滤可以得到较纯的青蒿素,故正确;C.加入乙醚进行萃取分液得到的还是混合物,故错误。故选B。(2)实验原理是测定一定质量的有机物完全燃烧时生成的二氧化碳和水的质量,来确定是否含氧及碳氢氧的个数比,求出最简式,因此生成氧气后必须除杂,明确各装置的作用是解题的前提。A是用来吸收二氧化碳,测定生成二氧化碳的质量,B用于干燥通入E中的氧气, C用来吸收水,测定生成水的质量, D用来制取反应所需的氧气,E是在电炉中加热时用纯氧气氧化管内样品,根据一氧化碳和氧化铜反应,可被氧化生成二氧化碳的性质可知氧化铜的作用是把有机物不完全燃烧产生的一氧化碳转化为二氧化碳。 ①D中生成的氧气含有水蒸气,应先通过B中的氯化钙吸收,在E中电炉加热时用纯氧气氧化管内样品,生成二氧化碳和水,如果有一氧化碳,则E中的氧化铜可以与一氧化碳进一步反应生成二氧化碳,然后分别通入装有浓硫酸的洗气瓶吸收水,通过装有氢氧化钠溶液的U型管吸收二氧化碳,根据产物的质量推断有机物的组成,所以仪器的接口顺序为dhifeab(或ba);②B装置的作用除去氧气中的水蒸气; ③氧化铜将可能生成的CO氧化为CO2;④A管质量增加66克,可得碳元素的质量为![]() =18g,C装置质量增加19.8g,可得氢元素的质量为
=18g,C装置质量增加19.8g,可得氢元素的质量为![]() =2.2g,从而推出含氧元素的质量为28.2-18-2.2=8g,设最简式为CxHyOz,则有x:y:z=
=2.2g,从而推出含氧元素的质量为28.2-18-2.2=8g,设最简式为CxHyOz,则有x:y:z= ![]() =15:22:5,最简式为C15H22O5 ;⑤若把盛有碱石灰的干燥管的装置去掉,则空气中的水和二氧化碳可能进入装置A中,使二氧化碳的质量增加,则氧元素的质量减少,测定氧的质量分数偏小;⑥测定了最简式之后,还需要该有机物的相对分子质量才能确定其分子式;⑦由于酯不溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠,结合题意可知青蒿素中含有酯基,而油脂中也含有酯基,故选D。
=15:22:5,最简式为C15H22O5 ;⑤若把盛有碱石灰的干燥管的装置去掉,则空气中的水和二氧化碳可能进入装置A中,使二氧化碳的质量增加,则氧元素的质量减少,测定氧的质量分数偏小;⑥测定了最简式之后,还需要该有机物的相对分子质量才能确定其分子式;⑦由于酯不溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠,结合题意可知青蒿素中含有酯基,而油脂中也含有酯基,故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x~h表示)的原子半径相对大小、最高正价或最低负价的变化如下图所示。
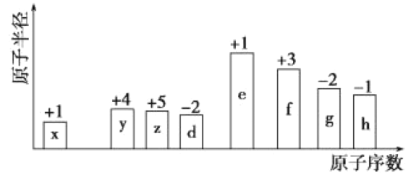
请回答下列问题:
(1)x形成的阴离子的结构示意图为_____________ 。
(2)如果z原子中含8个中子,则其原子符号为______________。
(3)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为_______________。
(4)比较d、e常见离子的半径大小:_______________(填离子符号,用“〉”表示)。
(5)g、h两元素最高价氧化物对应水化物酸性更强的是_____________。(填化学式)
(6)均含x、z、d三种元素的两种化合物发生中和反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 2004年12月26日,印度洋发生海啸,灾民饮用水被严重污染,急需进行净化处理。下列净化水的单一操作中,净化程度最高的是
A.蒸馏B.吸附沉淀C.过滤D.静置沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法错误是( )
盐卤![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl26H2O
MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
A. 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
B. 操作①发生的反应为非氧化还原反应
C. 操作②是蒸发浓缩结晶
D. 在整个制备过程中,未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A. H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B. 2NO2(g)![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C. CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D. N2(g)+3H2(g)![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5).其制备工艺流程如下:
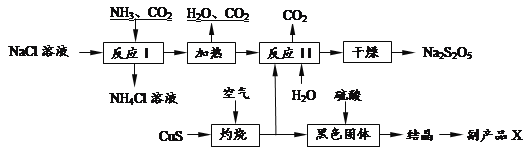
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应.
(1)反应I的化学方程式为:_____________________________________________________ .
(2)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:__________________________.
(3)反应I时应先通的气体为______,副产品X的化学式是______.
(4)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为______.检验产品中含有碳酸钠杂质所需试剂是______(填编号)
①酸性高锰酸钾②品红溶液③澄清石灰水
④饱和碳酸氢钠溶液⑤NaOH⑥稀硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+ CaCl2+ 2H2SO4 ![]() 2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。
2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。

试回答:
(1)该实验中A部分的装置是________(填写装置的序号)。
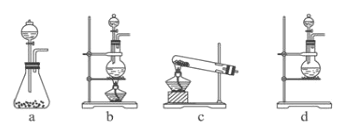
(2)B中的实验现象为___________________________ 。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因,_____________________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)_____________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
干海带![]() 海带灰
海带灰![]() 水溶液
水溶液![]()
![]()
![]() ―→碘单质
―→碘单质
下列有关叙述正确的是( )
A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com