
����Ŀ������ԭ�������ĵ��������ֶ�����Ԫ��(����ĸx��h��ʾ)��ԭ�Ӱ뾶��Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��
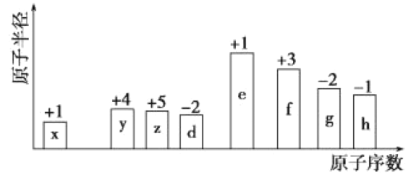
��ش��������⣺
��1��x�γɵ������ӵĽṹʾ��ͼΪ_____________ ��
��2�����zԭ���к�8�����ӣ�����ԭ�ӷ���Ϊ______________��
��3��f�ĵ��ʺ�e������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽΪ_______________��
��4���Ƚ�d��e�������ӵİ뾶��С��_______________�������ӷ��ţ�����������ʾ����
��5��g��h��Ԫ������������Ӧˮ�������Ը�ǿ����_____________�����ѧʽ��
��6������x��z��d����Ԫ�ص����ֻ�������кͷ�Ӧ�����ӷ���ʽ��__________________��
���𰸡�![]() 157N 2Al+2NaOH+2H2O==2NaAlO2+3H2�� O2- >Na+ HClO4 H++NH3��H2O==NH4++H2O
157N 2Al+2NaOH+2H2O==2NaAlO2+3H2�� O2- >Na+ HClO4 H++NH3��H2O==NH4++H2O
��������
��ͼ�еĻ��ϼۺ�ԭ�Ӱ뾶�Ĵ�С�������Ƴ�x��HԪ�أ�y��CԪ�أ�z��NԪ�أ�d��OԪ�أ�e��NaԪ�أ�f��AlԪ�أ�g��SԪ�أ�h��ClԪ�ء�
�ɷ�����֪��x��HԪ�أ�y��CԪ�أ�z��NԪ�أ�d��OԪ�أ�e��NaԪ�أ�f��AlԪ�أ�g��SԪ�أ�h��ClԪ�ء�
��1��x��HԪ�أ�HԪ���γɵ�������ΪH-��H-�Ľṹʾ��ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2��z��NԪ�أ�Nԭ�ӵ�������Ϊ7�����Nԭ���к�8�����ӣ���������Ϊ7+8=15������ԭ�ӷ���Ϊ![]() N���ʴ�Ϊ��
N���ʴ�Ϊ��![]() N��
N��
��3��f��AlԪ�أ�e��NaԪ�أ�Na������������Ӧ��ˮ����ΪNaOH��Al��NaOH��Һ��Ӧ����ƫ�����ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�����ʴ�Ϊ��2Al+2NaOH+2H2O=2NaAlO2+3H2����
��4��d��OԪ�أ�e��NaԪ�أ��γɵļ�����ΪO2-��Na+�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС����r(O2-)��r(Na+)���ʴ�Ϊ��O2- >Na+��
��5��g��SԪ�ء�h��ClԪ�أ�Ԫ�صķǽ�����Խǿ�����������ˮ���������Խǿ���ǽ����ԣ�Cl��S������������Ӧˮ���������HClO4��H2SO4���ʴ�Ϊ��HClO4��
��6��x��HԪ�أ�z��NԪ�أ�d��OԪ�أ���H��N��O����Ԫ�صĻ�����ΪHNO3��NH3��H2O��HNO3��NH3��H2O�����кͷ�Ӧ����NH4NO3��H2O����Ӧ�����ӷ���ʽΪ��H++NH3��H2O=NH4++H2O���ʴ�Ϊ��H++NH3��H2O=NH4++H2O��


 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ���Һ�������Ե��ǣ� ��
A.NaHCO3B.(NH4)2SO4C.CH3COONH4D.CH3COOK
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. ��NaOH��Һ��ͨ�����SO2��SO2+2OH -��SO32 - +H2O
B. ���Ȼ�淋���Һ�м�������ŨNaOH��Һ�����ȣ�NH4++OH -![]() NH3��H2O
NH3��H2O
C. Ba(OH)2��Һ��H2SO4��Һ��ϲ���������Ba2++ SO4 2 -��BaSO4��
D. ������������ϡ���ᷴӦ�����ӷ���ʽ��3Fe+8H++2NO3-��4H2O+2NO��+3Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ����ᡢ��Ρ��ǵ���ʵ�˳�����е���
A. ���ᡢ�������Ȼ�þ��������̼ B. ���ᡢ�ռ�ɱ����մ�ˮ
C. ���ᡢ��ʯ�ҡ�������ͭ D. �Ȼ��⡢�����ơ�NaHCO3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ﲻ��ͨ�����Ϸ�Ӧ��õ���
A. Ca(HCO3)2 B. Al(OH)3 C. NaOH D. FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��������п��Ͷ��100mL 18.5mol/L��Ũ�����У���п����ȫ�ܽ������ɵ�H2��SO2��33.6L����״��������ʱ��Һ������0.1mol H+�������֪��
��Ͷ��п��������Ϊ_____________g��
�����ɵ�H2��SO2�����ʵ���֮��Ϊ_____________��
��2��ȡ25.6 g Cu��һ������ijŨ�ȵ�ŨHNO3��Ӧ����ͭ��ȫ�ܽ���ռ���������NO��NO2��������ڱ�״���µ������11.2 L����
��������������ʵ���Ϊ_____________mol��
��NO�����ʵ���Ϊ_____________mol��NO2�����ʵ���Ϊ_____________mol��
�۵�ͭ��ȫ�ܽ�ʱ����Ӧ��ת�Ƶĵ�����ĿΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18g��������ϩ�Ļ����ͨ��ʢ��������ˮ��ϴ��ƿ����Ӧ����ˮ����14g�����������м������ϩ���������
A. 2��1 B. 1��2 C. 3��2 D. 2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��X��Y��Z��ԭ���������ε�����R����������Һ���ڲ��������Ͽ̱����R��X���γ�XR3�ͻ����X�ڻ�������ֻ��һ�ֻ��ϼ���R��Zλ��ͬ���壬Yԭ���������������ڵ��Ӳ�����2���������й��ƶ���ȷ����
A. R���ʺ�Z���ʾ�����ˮ������Ӧ�û���O2
B. ����Ԫ���γɵļ����Ӷ��ܴٽ�ˮ�ĵ���ƽ��
C. YR6���������о���ȼ��
D. Ԫ�ض�Ӧ�ļ����ӵİ뾶:Y>Z>R>X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��1��9�գ��й���ҽ��ѧԺ���Լ�ר���������о�Ա���2016��ȹ��ҿ�ѧ��������߽���������Ϊ���ĺ���������,��ɫ��״���壬�ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�棬���ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ��ijѧϰС��ģ�����������ȡ�����أ������ʵ��ⶨ�����صķ��ӽṹ��
(1)�����ص���ȡ
����������ȡ�����صķ�����Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��

��֪:���ѷе�Ϊ35�档
�ٲ���I������Ϊ______��
�ڲ���III����Ҫ���̿�����_____________��
A.��ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B.��95%���Ҵ���Ũ�����ᾧ������
C.�������ѽ�����ȡ��Һ
(2)�����ط���ʽ�IJⶨ
����ȼ�շ��ⶨ�����ص�ʵ��ʽ������װ������:
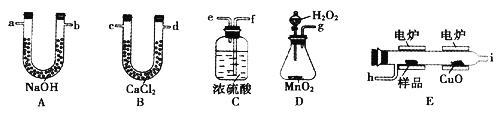
�ٲ�����������������������ѡװ�ø����ܵ�����˳����g��c��_______��ʢ�м�ʯ�ҵĸ����(װ�ò����ظ�ʹ��)��
��Bװ�õ�������______��
��Eװ����CuO��������_______��
�ܳ�ȡ28.2g��Ʒ(ֻ��C��H��O����Ԫ���е����ֻ�����)�������ȼ�պ�Aװ����������66g��Cװ����������19.8g������л�������ʽΪ_______��
������ʢ�м�ʯ�ҵĸ���ܵ�װ��ȥ�����������Ʒ����������������_____(�ƫ����ƫС�����䡱)��
��Ҫȷ�����л���ķ���ʽ,����Ҫ������������Ϊ_______��
�߽������ؼ�����з�̪NaOH��Һ�У��ܱ���ɫ�����Ա仯�����Ȳ����裬��Һ��ɫ��dz��˵�������ؿ�����_____(����ĸ)������ͬ�����ʡ�
A.�Ҵ� B.���� C.���� D.��֬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com