
现有含 NaCl、Na2SO4和NaNO3的混合溶液, 采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现 Cl-、SO42-和 NO3-的相互分离:其中试剂 1、2、4 分别为
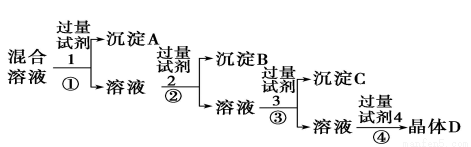
A.硝酸银溶液 硝酸钡溶液 稀硝酸
B.氯化钡溶液 稀硝酸 硝酸银溶液
C.氢氧化钠溶液 硝酸银溶液 稀硝酸
D.氯化钡溶液 硝酸银溶液 稀硝酸
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高一上10月月考化学试卷(解析版) 题型:选择题
实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道
C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学高一上10月阶段测化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法中正确的是
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.标准状况下,11.2L CCl4所含的分子数为0.5NA
C.0.5mol/L AlCl3溶液中Cl—的数目为2NA
D.17g氨气中含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(11分)甲、乙、丙三位同学分别进行如下实验:
(1)甲同学配制100 mL 0.5mol·L-1的氯化钠溶液。甲同学的基本操作如下,请你帮他把正确的顺序排出来 :(填字母)

(2)乙同学配制100 mL 0.5mol·L-1的稀硫酸。
①若采用18 mol·L-1的浓硫酸配制溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、 、____ 、胶头滴管。
②乙同学的如下操作中,使所配溶液的物质的量浓度偏小的是 :
a.准确量取2.7mL浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀
b.待溶解后立即转移到100 mL容量瓶中
C.用少量的稀硫酸将容量瓶洗涤2~3次
d.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至100mL。
③定容的正确操作是_________________________。
(3)丙同学:室温时,取10 mL乙同学所配硫酸溶液,向其中加水至100 mL,再用PH试纸测其PH的正确操作是_____________ __。若他测得PH为2,你认为可能的原因是 (只写一条)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第二次月考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO或HCO中的一种或两种
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,可能有Ba2+
D.加入硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第二次月考化学试卷(解析版) 题型:填空题
(每空2分,共8分)
已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
① | HF | Ka=6.8×10-4 mol•L-1 |
② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
③ | HCN | Ka=6.2×10-10 mol•L-1 |
④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最弱的是_____________________。
(2)写出H2CO3电离方程式是 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________ ______,
少量的CO2通入NaCN溶液中:_________ _____。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三10月月考化学试卷(解析版) 题型:推断题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:

(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:_________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________________;D中所含化学键的类型为____________________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的相对分子质量相等,请用离子方程式表示F的水溶液呈酸性的原因:_________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____________;B转化为C的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
下列溶液中c(NO3-)比100mL2 mol/L硝酸钡溶液中c(NO3-)大的是
A.300mL 1mol/L的硝酸钠溶液 B.200mL 1.5mol/L的硝酸镁溶液
C.100mL 1.5mol/L的硝酸铝溶液 D.200mL 3mol/L的硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期第二次月考化学试卷(解析版) 题型:选择题
根据下列实验内容得出的结论正确的是
选项 | 实验内容 | 结论 |
A | 某物质的水溶液能使红色石蕊试纸变蓝 | 该物质一定是氨气 |
B | 某气体能使湿润的淀粉?KI试纸变蓝 | 该气体一定是氧化性气体 |
C | 苯与溴水混合,溴水褪色 | 苯中含碳碳双键 |
D | 某物质燃烧后的产物既能使白色硫酸铜粉末变蓝,又能使澄清的石灰水变浑浊 | 该物质一定是碳氢化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com