
【题目】在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A,B,C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2.下列分析不正确的是( ) 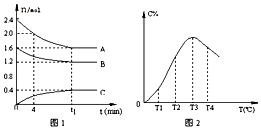
A.t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变
B.该反应的平衡常数表达式K= ![]()
C.由T1向T2变化时,V正>V逆
D.此反应的正反应为放热反应
【答案】A
【解析】解:根据图1知,随着反应的进行,A和B的物质的量减少,C的物质的量增大,则A和B是反应物,C是生成物,反应过程中,物质的量的变化量之比等于其计量数之比,所以A、B和C的计量数之比=(2.4﹣1.6)mol:(1.6﹣1.2)mol:(0.4﹣0)mol=0.8mol:0.4mol:0.4mol=2:1:1,当反应达到T3时,再升高温度C的含量降低,则正反应是放热反应,该反应的方程式为:2A(g)+B(g)C(g)△H<0.
A.在10L定容密闭容器中,混合气体质量不变、体积不变,密度始终不变,故A错误;
B.该反应方程式为:2A(g)+B(g)C(g),K= ![]() ,故B正确;
,故B正确;
C.由T1向T2变化时,C的含量增大,平衡向正反应方向移动,则正反应速率大于逆反应速率,故C正确;
D.该反应正反应是放热反应,故D正确;
故选A.


科目:高中化学 来源: 题型:
【题目】将5molL﹣1的盐酸10mL稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
A.0.5 molL﹣1
B.0.25 molL﹣1
C.0.1 molL﹣1
D.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述或化学用语表示正确的是( )
A.S2﹣的结构示意图: ![]()
B.过氧化氢的电子式: ![]()
C.Ge原子的简化电子排布式:[Ar]4s24p2
D.氯化钠的分子式:NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中有如下反应:mA(g)+nB(g)pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的 ![]() ,当达到新平衡时,C的浓度为原来的1.8倍.下列说法中正确的是( )
,当达到新平衡时,C的浓度为原来的1.8倍.下列说法中正确的是( )
A.m+n>p
B.A的转化率降低
C.平衡向正反应方向移动
D.C的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的质量的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半
B.均加倍
C.均减少1mol
D.均增加1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第族,其高价态离子核外有个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是(用离子符号表示).
(3)A,D两元素的简单氢化物发生反应生成的化合物的电子式为
(4)常温下AD3是一种淡黄色液体.以下关于AD3的说法中,正确的是
A.AD3分子中只有非极性键
B.AD3分子中各原子均达8e﹣稳定结构
C.AD3的晶体属于分子晶体
D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是;该过程总的离子反应式为向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是 A.配位键 B.极性共价键 C.非极性共价键 D.离子键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,极微溶于水,不溶于醇类。可与水缓慢反应,易与酸反应。实验室通常用CaCl2在碱性条件下与H2O2反应制得(该反应剧烈并大量放热),装置如图所示,请回答下面的问题:
I.CaO2的制备

(1)漏斗在使用时其上口的玻璃塞应________(填“打开”或“关闭”),支管B的作用是________。
(2)将盛有浓CaCl2溶液的装置置于冰水混合物中。其原因是:使反应平稳进行、___________。
(3)加入H2O2与浓氨水的混合溶液,使反应开始。
①反应的化学方程式是_______________。
②滴加H2O2与浓氨水混合溶液之前,还应进行的操作是______。
(4)待反应结束后,经______(填操作)得CaO2粗产品。
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量。
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度__________。
实验序号 | ① | ② | ③ | ④ |
消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
(6)测得CaO2样品的纯度偏低,其原因可能是______(选填编号)。
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)写出与H2O分子互为等电子体的一种阴离子的化学式为 .
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)向CuSO4溶液中滴加氨水,先产生蓝色沉淀,然后沉淀溶解,溶液呈深蓝色.请写出生成配合离子的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com