
����Ŀ��A��B��C��D��E��F��Ԫ�����ڱ�ǰ��������ԭ������������������ֳ���Ԫ�أ��������Ϣ�����
Ԫ�� | �� �� �� Ϣ |
A | ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��� |
B | ��Χ�����Ų�ʽΪnsnnpn+2 |
C | �����Ľ����������ڱ���������������������� |
D | ��̬�⻯�P����������Ӧ��ˮ�����Ϊǿ�� |
E | һ�ֺ��ص�������Ϊ56��������Ϊ30 |
F | �����Ϻ�ɫ�����²��ϣ�����������Ϊ��ɫ |
�ش��������⣺
��1��Ԫ��E��Ԫ�����ڱ��е�λ�ڵ������ڵ��壬���̬���Ӻ�������δ�ɶԵ���
��2��B��C��D����Ԫ�ص����Ӱ뾶��С�����˳�����������ӷ��ű�ʾ����
��3��A��D��Ԫ�صļ��⻯�����Ӧ���ɵĻ�����ĵ���ʽΪ
��4��������AD3��һ�ֵ���ɫҺ�壮���¹���AD3��˵���У���ȷ����
A.AD3������ֻ�зǼ��Լ�
B.AD3�����и�ԭ�Ӿ���8e���ȶ��ṹ
C.AD3�ľ������ڷ��Ӿ���
D.AD3Һ������ʱ��ѧ�����ƻ�
��5������C��E�ĺ�ɫ���Ծ����������ڸ����·�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ
��6����F����������Һ��ͨ��AH3�������������۲쵽�����������ù����ܵ����ӷ�ӦʽΪ��Ӧ�����Һ�м��������Ҵ�����������ɫ���壬�þ����в����еĻ�ѧ�������� A����λ�� ����������B�����Թ��ۼ��������� ��C���Ǽ��Թ��ۼ�����������D�����Ӽ���
���𰸡�
��1������5
��2��r��Al3+����r��O2������r��Cl����
��3��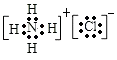
��4��BC
��5��3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
��6����ɫ��Һ�Ȳ�����ɫ����,�������ܽ�,�γ�����ɫ��Һ�� Cu2++4NH3=[Cu��NH3��4]2+��Cu2++4 NH3?H2O=[Cu��NH3��4]2++4H2O�� C
���������⣺��1��һ�ֺ��ص�������Ϊ56��������Ϊ30��������=������������������������=56��30=26��Ϊ��Ԫ�أ�ԭ������Ϊ26�������������ԭ����д�������Ų�ʽΪ1S22S22P63S23P63d64s2��λ�ڵ������ڣ��ڢ��壬ʧȥ3�����ӱ�Ϊ�����ӣ������Ų�ʽΪ1S22S22P63S23P63d5����֪��3d�ϴ���5��δ�ɶԵ��ӣ�
���Դ��ǣ�����5����2��B����Χ�����Ų�ʽΪnSnnPn+2��s�ܼ�����2�����ӣ���n=2������Χ�����Ų�Ϊ2S22P4����BΪOԪ�أ�
C��Ԫ��������������������������ȣ���CΪAl��
D����̬�⻯�P����������Ӧ��ˮ�����Ϊǿ��Ϊ�Ȼ��壬�����������Ϊ35����E��������Ϊ26������DΪ�ȣ�
������������ӣ�������������ӣ�������������ӣ��Һ�������Ų���ͬ�����뾶��С����������Ų������뾶�����������Ӵ��������Ӻ������ӣ�ͬ��������Ų�������������Խ�뾶ԽС�����������Ӱ뾶���������ӣ��������ߵİ뾶��СΪ��r��Al3+����r��O2������r��Cl������
���Դ��ǣ�r��Al3+����r��O2������r��Cl��������3���Ȼ�������ӻ�����ɰ��������������ӹ��ɣ�����ʽΪ�� 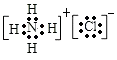 ��
��
���Դ��ǣ� 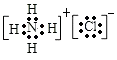 ����4��A��NCl3������ֻ����N��Cl���Լ�����A����
����4��A��NCl3������ֻ����N��Cl���Լ�����A����
B��NCl3�У�N�ļ۵�����Ϊ5�����ϼ�Ϊ+3�ۣ�N���������Ϊ5+3=8������8�����ȶ��ṹ��Cl�ļ۵�����Ϊ7�����ϼ�Ϊ��1�ۣ�Cl������������Ϊ7+|��1|=8������8�����ȶ��ṹ����B��ȷ��
C������Ϣ��֪��������ΪҺ�壬��NCl3����Ϊ���Ӿ��壬��C��ȷ��
D��NCl3Һ������ʱ���Ӽ����������ƻ���û���ƻ������ڵĻ�ѧ������D����
��ѡBC����5������CΪ����E�ĺ�ɫ���Ծ���������Ϊ�����������������������������Fe3O4���������ȼ�����·�����Ӧ���������µ�ͬʱ������������Al2O3��������Һ̬�����ں��ӣ�����ӦΪ��3Fe3O4+8Al ![]() 9Fe+4Al2O3��
9Fe+4Al2O3��
���Դ��ǣ�3Fe3O4+8Al ![]() 9Fe+4Al2O3����6��������ͭ��Һ��ͨ������������Ȳ�����ɫ������ͭ���������ӷ���ʽΪCu2++2NH3H2O=Cu��OH��2��+2NH4+�������μӣ��γ�������İ���ͭ����ʹ�����ܽ⣬���ӷ���ʽΪ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH��+4H2O�������ӷ���ʽΪ��Cu2++4NH3=[Cu��NH3��4]2+��Cu2++4 NH3H2O=[Cu��NH3��4]2++4H2O������Ϊ��ɫ��Һ�Ȳ�����ɫ�������������ܽ⣬�γ�����ɫ��Һ��[Cu��NH3��4]SO4����������Ӻ�[Cu��NH3��4]2+�������Ӽ���Nԭ�Ӻ�ͭԭ��֮�������λ����NH3��H��N֮����ڼ��Թ��ۼ�������[Cu��NH3��4]SO4�������Ļ�ѧ���м��Թ��ۼ������Ӽ�����λ���������Ǽ��Թ��ۼ���C���ϣ�
9Fe+4Al2O3����6��������ͭ��Һ��ͨ������������Ȳ�����ɫ������ͭ���������ӷ���ʽΪCu2++2NH3H2O=Cu��OH��2��+2NH4+�������μӣ��γ�������İ���ͭ����ʹ�����ܽ⣬���ӷ���ʽΪ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH��+4H2O�������ӷ���ʽΪ��Cu2++4NH3=[Cu��NH3��4]2+��Cu2++4 NH3H2O=[Cu��NH3��4]2++4H2O������Ϊ��ɫ��Һ�Ȳ�����ɫ�������������ܽ⣬�γ�����ɫ��Һ��[Cu��NH3��4]SO4����������Ӻ�[Cu��NH3��4]2+�������Ӽ���Nԭ�Ӻ�ͭԭ��֮�������λ����NH3��H��N֮����ڼ��Թ��ۼ�������[Cu��NH3��4]SO4�������Ļ�ѧ���м��Թ��ۼ������Ӽ�����λ���������Ǽ��Թ��ۼ���C���ϣ�
���Դ��ǣ���ɫ��Һ�Ȳ�����ɫ�������������ܽ⣬�γ�����ɫ��Һ��Cu2++4NH3=[Cu��NH3��4]2+��Cu2++4 NH3H2O=[Cu��NH3��4]2++4H2O��C��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ˮ�е�ijЩ�ɷ֣����������ʣ�û�й�ϵ���ǣ� ��
A.��Na2CO3����������Ƶ���ˮ�У�����ɫ���ݣ�H+��
B.�����KI��Һ�еμ�������ˮ����Һ������Cl2��
C.��AgNO3��Һ�μӵ�������ˮ�У��а�ɫ����������Cl����
D.������ˮʹ��ɫ������ɫ��HCl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ���£����������У���0.3moLH2O����ͬ��ԭ�����������ǣ� ��
A.0.6mol H2SO4
B.3.612��1023��HNO3����
C.7.3g HCl
D.4.48L CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�NO��NH3���Է�����Ӧ��6NO+4NH3=5N2+6H2O���÷�Ӧ�б������ͱ���ԭ�ĵ�Ԫ�ص��������ǣ� ��
A.3��2
B.2��1
C.1��1
D.2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10L�����ܱ������У�A��B��C������̬���ʹ����˿��淴Ӧ����ϵ������ijһ�¶�ʱ��A��B��C���ʵ�����ʱ��Ĺ�ϵ��ͼ1��C�İٷֺ������¶ȵĹ�ϵ��ͼ2�����з�������ȷ���ǣ������� 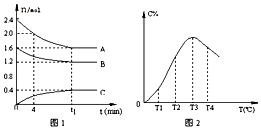
A.t1ʱ��ǰ�����������ܶȼ�С��t1ʱ�̺��������ܶȲ���
B.�÷�Ӧ��ƽ�ⳣ������ʽK= ![]()
C.��T1��T2�仯ʱ��V����V��
D.�˷�Ӧ������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��X��F�����ڱ���ǰ�����ڵ�����Ԫ�أ����ǵ�ԭ����������������AԪ�صĺ���������͵��Ӳ�����ȣ�����������ḻ��Ԫ����B������������Ϊ���ڲ��������2����D��̬ԭ�ӵ�s�ܼ���p�ܼ��ϵ�������ȣ�E�ڶ�����Ԫ���е�һ��������С��X��Dͬ���壬F�����ڱ��ĵڰ��С�
��1����̬Fԭ�ӵĺ�����_______���˶�״̬�ĵ��ӡ���̬F3+�����������Ų�ʽ��________��
��2��B��C��D����Ԫ�صĵ縺���ɴ�С��������_______(��Ԫ�ط���)��
��3��A��B��D�γ�BA2D�ͷ��ӣ��÷��ӵĿռ乹��Ϊ________��
��4��BC-��Bԭ�ӵ��ӻ����������_______���������к��е���������������Ŀ֮��Ϊ_____��д��һ����÷��ӻ�Ϊ�ȵ�����ĵ��ʷ��ӵĽṹʽ_______��
��5��E2X��E2D��Ƚ��۵�ϸߵ���______(�ѧʽ),ԭ����__________��
��6���W������B�ܽ���F���γɵ�һ�ּ�϶�����壬����,�侧��Ϊ���������ṹ,��ͼ��ʾ,������ʵĻ�ѧʽΪ_______���������ܶ�Ϊdg.cm-3,�������������Bԭ�ӵľ���Ϊ______pm(�����ӵ�������ֵ��NA��ʾ��д����ļ���ʽ����)��
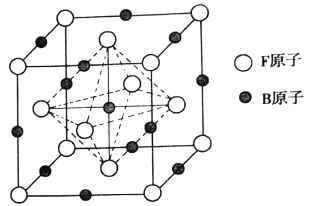
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H �������Ϊ1L���ܱ������У�����CO2��H2 �� ʵ���÷�Ӧ��ϵ�����ʵ����ʵ�����ʱ���ϵ���±���
n��CO2�� | n��H2�� | n��CH3OH��g�� | n��H2O��g�� | |
0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
5min | 0.50mol | 0.50mol | ||
10min | 0.25mol | 0.75mol | ||
15min | 0.25mol | n1 |
�ش��������⣺
��1�������е�n1=
��2��0��5min�� v ��H2��=
��3����������CO2��ƽ��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���ڲ�����ȡ����Ӧ���ǣ� ��
A.��֬��ˮ��
B.��һ�������£�����Ũ���ᷴӦ��ȡ������
C.��ȩ�������ķ�Ӧ
D.�����������ڹ��������·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ᾧ��Ļ�ѧʽ�ɱ�ʾΪH2C2O4xH2O��Ϊ�ⶨx��ֵ����������ʵ�飺 �ٳ�ȡ7.56gij���ᾧ�����100.0mL��ˮ��Һ��
������Һ����ȡ25.00mL������Һ������ƿ�У���������ϡH2SO4 �� ��Ũ��Ϊ0.600mol/L��KMnO4��Һ�ζ����ζ��յ�ʱ����KMnO4 �����Ϊ10.00mL��
��1�����ζ��յ�ʱ���Ӷ�����������x��ֵ�����ƫ��ƫС������
��2��x= ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com