
����Ŀ����֪��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H �������Ϊ1L���ܱ������У�����CO2��H2 �� ʵ���÷�Ӧ��ϵ�����ʵ����ʵ�����ʱ���ϵ���±���
n��CO2�� | n��H2�� | n��CH3OH��g�� | n��H2O��g�� | |
0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
5min | 0.50mol | 0.50mol | ||
10min | 0.25mol | 0.75mol | ||
15min | 0.25mol | n1 |
�ش��������⣺
��1�������е�n1=
��2��0��5min�� v ��H2��=
��3����������CO2��ƽ��ת����Ϊ ��
���𰸡�
��1��0.75mol
��2��0.3mol?L��1?min��1
��3��75%
���������⣺�ɱ��������ݿ�֪��10min�ﵽƽ�⣬���ʵ������䣬��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | |
��ʼ | 1.00 | 3.25 | 0 | 0 |
ת�� | 0.75 | 2.25 | 0.75 | 0.75 |
ƽ�� | 0.25 | 1.00 | 0.75 | 0.75 |
;��1��������������֪�������е�n1=0.75mol�����Դ��ǣ�0.75mol����2��0��5min�� v ��H2��= ![]() ��3=0.3 molL��1min��1�����Դ��ǣ�0.3 molL��1min��1����3����������CO2��ƽ��ת����Ϊ
��3=0.3 molL��1min��1�����Դ��ǣ�0.3 molL��1min��1����3����������CO2��ƽ��ת����Ϊ ![]() ��100%=75%�����Դ��ǣ�75%��
��100%=75%�����Դ��ǣ�75%��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��ļ��㣬��Ҫ�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ6NO2��8NH3��7N2��12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��

����˵������ȷ����
A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ��2NH3��6e����N2��6H��
D. ����4.48LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������������·�Ӧ��mA��g��+nB��g��pC��g���ﵽƽ������¶Ȳ��䣬�����������С��ԭ���� ![]() �����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1.8��������˵������ȷ���ǣ�������
�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1.8��������˵������ȷ���ǣ�������
A.m+n��p
B.A��ת���ʽ���
C.ƽ��������Ӧ�����ƶ�
D.C��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��Ԫ�����ڱ�ǰ��������ԭ������������������ֳ���Ԫ�أ��������Ϣ�����
Ԫ�� | �� �� �� Ϣ |
A | ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��� |
B | ��Χ�����Ų�ʽΪnsnnpn+2 |
C | �����Ľ����������ڱ���������������������� |
D | ��̬�⻯�P����������Ӧ��ˮ�����Ϊǿ�� |
E | һ�ֺ��ص�������Ϊ56��������Ϊ30 |
F | �����Ϻ�ɫ�����²��ϣ�����������Ϊ��ɫ |
�ش��������⣺
��1��Ԫ��E��Ԫ�����ڱ��е�λ�ڵ������ڵ��壬���̬���Ӻ�������δ�ɶԵ���
��2��B��C��D����Ԫ�ص����Ӱ뾶��С�����˳�����������ӷ��ű�ʾ����
��3��A��D��Ԫ�صļ��⻯�����Ӧ���ɵĻ�����ĵ���ʽΪ
��4��������AD3��һ�ֵ���ɫҺ�壮���¹���AD3��˵���У���ȷ����
A.AD3������ֻ�зǼ��Լ�
B.AD3�����и�ԭ�Ӿ���8e���ȶ��ṹ
C.AD3�ľ������ڷ��Ӿ���
D.AD3Һ������ʱ��ѧ�����ƻ�
��5������C��E�ĺ�ɫ���Ծ����������ڸ����·�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ
��6����F����������Һ��ͨ��AH3�������������۲쵽�����������ù����ܵ����ӷ�ӦʽΪ��Ӧ�����Һ�м��������Ҵ�����������ɫ���壬�þ����в����еĻ�ѧ�������� A����λ�� ����������B�����Թ��ۼ��������� ��C���Ǽ��Թ��ۼ�����������D�����Ӽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CaO2)��һ�ְ�ɫ���壬������ˮ�������ڴ��ࡣ����ˮ������Ӧ�������ᷴӦ��ʵ����ͨ����CaCl2�ڼ�����������H2O2��Ӧ�Ƶ�(�÷�Ӧ���Ҳ���������),װ����ͼ��ʾ,��ش����������:
I��CaO2���Ʊ�

��1��©����ʹ��ʱ���ϿڵIJ�����Ӧ________������رա�����֧��B��������________��
��2����ʢ��ŨCaCl2��Һ��װ�����ڱ�ˮ������С���ԭ���ǣ�ʹ��Ӧƽ�Ƚ��С�___________��
��3������H2O2��Ũ��ˮ�Ļ����Һ��ʹ��Ӧ��ʼ��
�ٷ�Ӧ�Ļ�ѧ����ʽ��_______________��
�ڵμ�H2O2��Ũ��ˮ�����Һ֮ǰ����Ӧ���еIJ�����______��
��4������Ӧ������______�����������CaO2�ֲ�Ʒ��
��CaO2���ȵIJⶨ����һ������CaO2����ϡ���ᣬ�ñ�KMnO4��Һ�ζ����ɵ�H2O2(KMnO4��Ӧ������Mn2+��������ȷ��CaO2�ĺ�����
��5����ÿ�γ�ȡ0.4000g��Ʒ�ܽ����0.1000mol/L��KMnO4��Һ�ζ������õ��������±���ʾ������Ʒ�Ĵ���__________��
ʵ����� | �� | �� | �� | �� |
����KMnO4���/mL | 19.98 | 20.02 | 20.20 | 20.00 |
��6�����CaO2��Ʒ�Ĵ���ƫ�ͣ���ԭ�������______��ѡ���ţ���
A.�濾ʱ�䲻��
B������KMnO4����Һ����ʱ��������ƿ�̶���
C.�ڽྻ�������ʽ�ζ�����δ��ϴ��װ��Һ
D���ζ�ǰ���첿�������ݣ��ζ�����ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʵķ�������ȷ���ǣ� ��
A.��ȥNa2CO3����������NaHCO3������
B.��ȥCO2������SO2��ͨ������NaHCO3��Һ
C.��ȥ�����������Ȼ��⣺ͨ������������Һ
D.��ȥ������������������������������ռ���Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ���ǣ� ��
A.��������ˮ��Ӧ
B.��ʯȼ�ϵ�ȼ��
C.���������������Ȼ�茶�����
D.�������������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d���ֽ������±���װ�ý���ʵ�顣����˵����ȷ����

A. װ�ü��л�ѧ��ȫ��ת��Ϊ����
B. װ������b�缫�����ĵ缫��ӦʽΪCu2++2e-=Cu
C. װ�ñ���SO42-��a�缫�ƶ�����Һ��pH��С
D. ���ֽ��������ǿ������˳����b>e>d>a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������°����ܱ�����������N2������������Ũ��ˮ����ܵ��Ƿ�й©������ij��ȤС����ʵ���Ҷ�����������Ӧ������̽�����ش���������:
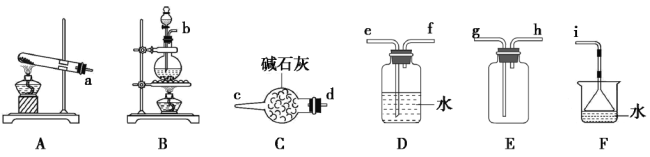
(1)�����ķ���װ�ÿ���ѡ����ͼ�е�_________(���д��ĸ)����Ӧ�����ӷ���ʽΪ________________��
(2)���ռ�һƿ����İ�����ѡ����ͼ�е�װ�ã�������˳��Ϊ:����װ�á�________(������������Сд��ĸ��ʾ)��
II.�����백���ķ�Ӧ
�����£����ռ����������백������ͼ��ʾװ����ʵ��(ʵ��ǰK1��K2�ر�)��

(3)Ϊʹ���������ֻ�ϣ�����a��___________(�ѧʽ)��
(4)
�������� | ʵ������ | ����ԭ�� |
��K1�������ƶ�ע�������������� ����ע������a (Լ������b��3������ �ر�K1���ָ����� | �Թ��ڳ��ְ��̲��� �Թ��ڱ����� | �ٷ�Ӧ�Ļ�ѧ����ʽ________ |
��K2 | ��_________ | ��_________ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com