
【题目】由a、b、c、d四种金属按下表中装置进行实验。下列说法正确的是

A. 装置甲中化学能全部转化为电能
B. 装置乙中b电极发生的电极反应式为Cu2++2e-=Cu
C. 装置丙中SO42-向a电极移动,溶液的pH变小
D. 四种金属活动性由强到弱的顺序是b>e>d>a
【答案】B
【解析】甲装置中,金属b不断溶解说明该装置构成了原电池,且b失电子发生氧化反应而作负极,a作正极;乙中b的质量增加,说明b上铜离子得电子发生还原反应,则b作原电池正极,c作负极;丙装置中d上有气体产生,说明d上氢离子得电子发生还原反应,则d作原电池正极,a作负极,作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:c>b>a>d。
A. 装置甲为原电池,化学能转化为电能,但有部分转化为热能,故A错误;
B. 装置乙中b的质量增加,说明b上铜离子得电子发生还原反应,b电极发生的电极反应式为Cu2++2e-=Cu,故B正确;
C. 装置丙中a作负极,d作正极,SO42-向a电极移动,正极上发生反应:2H++2e-=H2↑,溶液的pH变大,故C错误;
D.通过以上分析,四种金属活动性由强到弱的顺序是c>b>a>d,故D错误;
所以B选项正确。


科目:高中化学 来源: 题型:
【题目】在标况下,下列物质中,与0.3moLH2O含相同氢原子数的物质是( )
A.0.6mol H2SO4
B.3.612×1023个HNO3分子
C.7.3g HCl
D.4.48L CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H 现在体积为1L的密闭容器中,充入CO2和H2 . 实验测得反应体系中物质的物质的量与时间关系如下表,
n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
5min | 0.50mol | 0.50mol | ||
10min | 0.25mol | 0.75mol | ||
15min | 0.25mol | n1 |
回答下列问题:
(1)表格中的n1=
(2)0﹣5min内 v (H2)=
(3)该条件下CO2的平衡转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于不属于取代反应的是( )
A.油脂的水解
B.在一定条件下,苯与浓硝酸反应制取硝基苯
C.乙醛与氢气的反应
D.甲烷与氯气在光照条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( ) 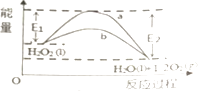
A.有MnO2条件下的反应曲线是a曲线
B.a曲线变为b曲线,反应的活化分子百分数增大
C.a曲线变为b曲线,平衡时H2O2的转化率增大
D.b曲线的热化学方程式为:H2O2(l)═H2O(l)+ ![]() O2(g)△H=﹣(E1﹣E2)KJmol﹣1
O2(g)△H=﹣(E1﹣E2)KJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅根据题中图示得出的结论不合理的是( )
A | B | C | D | |
图示 |
|
|
|
|
结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下,用1Llmol/LNa2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法不正确的是
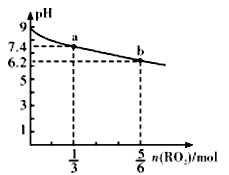
A. a点溶液中2c(Na+)>3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2的溶液呈中性时,c(Na+)=2c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验: ①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4 , 用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期p区元素共有13种,除铝外全部是非金属元素。
(1)基态氮原子的价层电子排布图为_______________;短周期p区元素中,第一电离能最小的元素与电负性最大的元素组成的化合物是_______________(填化学式)。
(2)卤素与硼、氮、磷可形成BF3,NCl3和PBr3。下列有关以上三种分子的叙述正确的是_________;
A.化学键类型相同 B.空间构型相同
C.中心原子的杂化轨道类型相同 D.中心原子的价层电子对数相同
(3)CS2是一种溶剂,它能溶解硫磺。写出一种与CS2具有相同空间构型和键合形式的分子或离子______________。CO能与Ni形成正四面体型的配合物Ni(CO)4,3.42gNi(CO)4中含有_____molσ键。
(4)CCl4与水互不相溶,SiCl4与CCl4分子结构相似,但遇水极易发生水解反应,导致二者性质不同的原因是________________。
(5)铝的几种卤化物的熔点如下:
卤化铝 | AlF3 | AlCl3 | AlBr3 | AlI3 |
熔点/℃ | 1040 | 190 | 97.5 | 191 |
AlBr3的晶体类型是______,AlI3晶体中存在的作用力有_______________。
(6)氮化铝晶体为原子品体,是一种新型无机非金属材料,其晶体密度为ɑg/cm3,晶胞如图所示。
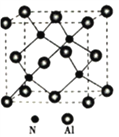
①铝原子的配位数为_______________。
②设NA为阿伏加德罗常数的值。氮化铝晶胞中,铝原子和氮原子之间最短的核间距为________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com