
【题目】水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)写出与H2O分子互为等电子体的一种阴离子的化学式为 .
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)向CuSO4溶液中滴加氨水,先产生蓝色沉淀,然后沉淀溶解,溶液呈深蓝色.请写出生成配合离子的离子方程式: .
【答案】
(1)NH2﹣
(2)A
(3)Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH﹣+4H2O
【解析】解:(1)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为NH2﹣,
所以答案是:NH2﹣;(2)A.水分子中O原子价层电子对个数=2+ ![]() ×(6﹣2×1)=4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+
×(6﹣2×1)=4,所以采用sp3杂化,H3O+中氧原子价层电子对个数=3+ ![]() ×(6﹣1﹣3×1)=4,杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
×(6﹣1﹣3×1)=4,杂化为sp3,则氧原子的杂化类型没有改变,故A错误;
B.水分子中O原子含有2个孤电子对,所以O原子采用sp3杂化,其空间构型为V形结构;H3O+为三角锥型,则微粒的形状发生了改变,故B正确;
C.H2O为中性分子,H3O+为酸性的阳离子,微粒的化学性质发生了改变,故C正确;
D.水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D正确;
所以答案是:A;(3)向CuSO4的水溶液中逐滴加入氨水,离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2H2O,生成氢氧化铜沉淀,氢氧化铜和氨水继续反应生成铜氨络合物,离子方程式为Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O,
所以答案是:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A,B,C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2.下列分析不正确的是( ) 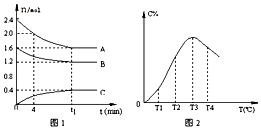
A.t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变
B.该反应的平衡常数表达式K= ![]()
C.由T1向T2变化时,V正>V逆
D.此反应的正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示,下列说法正确的是( ) 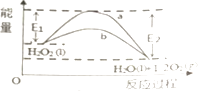
A.有MnO2条件下的反应曲线是a曲线
B.a曲线变为b曲线,反应的活化分子百分数增大
C.a曲线变为b曲线,平衡时H2O2的转化率增大
D.b曲线的热化学方程式为:H2O2(l)═H2O(l)+ ![]() O2(g)△H=﹣(E1﹣E2)KJmol﹣1
O2(g)△H=﹣(E1﹣E2)KJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2RO3是一种二元酸,常温下,用1Llmol/LNa2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法不正确的是
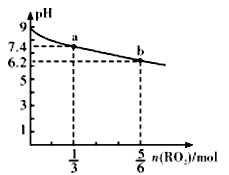
A. a点溶液中2c(Na+)>3c(RO32-)
B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4
C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D. 当吸收RO2的溶液呈中性时,c(Na+)=2c(RO32-)+c(HRO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶液 的c(H+)、c(OH﹣)之比取为AG[AG=lg ![]() ].25℃时,用0.01mol.L﹣1的氢氧化钠溶液滴定20mL相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( )
].25℃时,用0.01mol.L﹣1的氢氧化钠溶液滴定20mL相同物质的量浓度的醋酸溶液,滴定曲线如图所示.下列有关叙述正确的是( ) 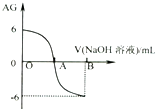
A.A点时c(CH3COO﹣)>c(Na+)
B.室温时0.01mol.L﹣1的醋酸溶液pH=6
C.OA段溶液中均有:c(CH3COO﹣)>c(CH3COOH)
D.若B点时加入NaOH溶液40mL,所得溶液中:c(CH3COO﹣)+2c(CH3COOH)=c(OH﹣)﹣c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验: ①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4 , 用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯  (g)+CO2(g)
(g)+CO2(g) 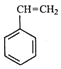 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.  (g)
(g)  (g)+H2(g)△H1=﹣125KJ/mol
(g)+H2(g)△H1=﹣125KJ/mol
B.H2(g)+CO2(g)CO(g)+H2O(g)△H2=﹣41KJ/mol
(1)上述乙苯与CO2反应的反应热△H为
(2)苯乙烯与HCl加成的产物中具有手性异构体的分子的结构简式为 .
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示. 
①实验I乙苯在0﹣50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)25℃时,将体积为Va PH=a的某一元强碱与体积为Vb PH=b的某二元强酸混合.若所得混合溶液的pH=11,且a=13,b=2,则Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5.X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物.请回答:
(1)X元素的名称是;Y元素的名称是;Z元素的名称是 .
(2)XZ3化合物的电子式是 .
(3)分别写出X、Y的含氧酸的分子式、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.工业生产中,500℃左右比常温下更有利于合成氨
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com