
| ||
| △ |
| Cu |
| △ |
| Cu |
| △ |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
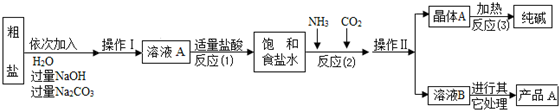
| 选择的装置 (填编号) |
实验现象 | 实验结论 |
| 样品不含晶体A |

查看答案和解析>>
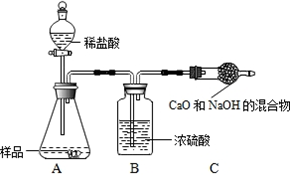
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 固体电解质是通过离子迁移传递电荷.如RbAg4I5晶体,其中迁移的物种全是Ag+,利用RbAg4I5晶体,可以制成电化学气敏传感器,图是一种测定O2含量的气体传感器示意图.被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量.在气体传感器工作过程中,下列变化肯定没有发生的是( )
固体电解质是通过离子迁移传递电荷.如RbAg4I5晶体,其中迁移的物种全是Ag+,利用RbAg4I5晶体,可以制成电化学气敏传感器,图是一种测定O2含量的气体传感器示意图.被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量.在气体传感器工作过程中,下列变化肯定没有发生的是( )| A、Ag-e-═Ag+ |
| B、I2+2Ag++2e-═2AgI |
| C、I2+2Rb++2e-═2RbI |
| D、4AlI3+3O2═2Al2O3+6I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com