
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学 方程式(未配平)
方程式(未配平)
①NO+HNO3―→N2O3+H2 O
O
②NH3+NO― →HNO2+H2O
→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______。
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
解析 (1)根据元素化合价升降分析判断。(2)若含有同种元素不同价态的两种物质发生氧化还原反应时,生成物中该元素的价态应介于两种反应物元素价态之间。N元素-3价与+2价之间应为0价或+1价,不可能出现+3价的氮,所以②式不能实现。(3)由①知氧化性:FeCl3>I2,还原性:I->Fe2+;由②知氧化性:Cl2>FeCl3,还原性:Fe2+>Cl-;由③知氧化性:KMnO4>Cl2,还原性:Cl->Mn2+ ,由此推知氧化性强弱顺序为KMnO4>Cl2>FeCl3>I2,还原性强弱顺序为I->Fe2+>Cl->Mn2+。所以KMnO4可氧化Cl-、Fe2+及I-,FeCl3只氧化I-。所以必须选择比Cl2氧化能力的差而比I2氧化能力强的氧化剂FeCl3。
,由此推知氧化性强弱顺序为KMnO4>Cl2>FeCl3>I2,还原性强弱顺序为I->Fe2+>Cl->Mn2+。所以KMnO4可氧化Cl-、Fe2+及I-,FeCl3只氧化I-。所以必须选择比Cl2氧化能力的差而比I2氧化能力强的氧化剂FeCl3。
答案 (1)Fe3+、Mg2+、H+ I-、S2- Fe2+、S (2)②
(3)KMnO4 FeCl3


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值,下列说法正确的是
( )。
A.25 ℃时,pH=2的1.0 L H2SO4溶液中含有H+的数目为0.02 NA
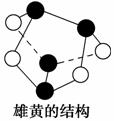
B.0.5 mol雄黄(As4S4,所有原子都满足8电子结构, 结构如图)含有NA个S—S键
结构如图)含有NA个S—S键
C.39 g苯分子中共含6 NA个共价单键
D.向FeI2、NaBr的混合溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应转移电子的数目至少为3 NA
mol Fe2+被氧化时,该反应转移电子的数目至少为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程的离子方程式正确的是
A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O
B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq)
C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓
D.金属Na与水反应:Na +2H+ = H2↑+Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
A.I2在反应①中是还原产物,在反应②中是氧化产物
B.两个反应中生成等量的I2时转移的电子数相等
C.NaI和NaIO3在一定条件下能反应生成I2
D.NaIO3在化学反应中只能作氧化剂不能作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
根据右图提供的信息,下列所得结论不正确的是( )
 A.反应物比生成物稳定
A.反应物比生成物稳定
B.该图可以表示石灰石高温分解
C.该反应的△H>0
D.因为生成物的总能量高于反应物的总能量
该反应一定需要加热
查看答案和解析>>
科目:高中化学 来源: 题型:
向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时
间的变化曲线如图所示(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则 影响v1、v2、v3反应速率的
 因素是 ;
因素是 ;
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)
A、 蒸馏水 B、氯化钾固体
C、氯化钠溶液 D、浓盐酸
 (3)加入CaCO3的质量为 。
(3)加入CaCO3的质量为 。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率
 V(HCL)== 。
V(HCL)== 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质(括号内为杂质)的方法正确的是
①乙烷(乙烯) 光照条件下通入Cl2,气液分离 ②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液 ③苯(苯酚) 用氢氧化钠溶液洗涤、分液 ④乙醇(水) 加足量生石灰、蒸馏
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com