
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
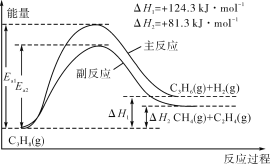
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
【答案】增大 增大 副反应的活化能低于主反应的活化能 Ⅰ 3.3×103Pa CrO3 C3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(l) ΔH=+121.5kJ/mol 碳与CO2反应生成CO,脱离催化剂表面
C3H6(g)+CO(g)+H2O(l) ΔH=+121.5kJ/mol 碳与CO2反应生成CO,脱离催化剂表面
【解析】
(1)根据平衡移动原理及转化率概念分析解答;(2)根据图示及平衡移动原理、平衡常数表达式分析解答;(3)根据反应机理图及催化剂的作用机理分析解答,根据盖斯定律计算反应热并书写热化学方程式。
(1)①由题可知,丙烷脱氢制丙烯为吸热反应,恒压时若向原料气中掺入水蒸气,体系温度升高,平衡向正反应方向移动,化学平衡常数K增大,丙烷的转化率增大;
②由图可知,副反应的活化能低于主反应的活化能,温度升高,活化能较低的副反应更容易发生。故答案为:增大;增大;副反应的活化能低于主反应的活化能;
(2)①丙烷脱氢制丙烯为气体体积增大的反应,增大压强,平衡向逆反应方向移动,丙烯的平衡体积分数减小;该反应为吸热反应,温度升高,平衡向正反应方向移动,故曲线Ⅰ代表104Pa时丙烯的平衡体积分数;
②104Pa、500℃时,丙烯的平衡体积分数为33%,设起始丙烷为1mol,转化率为x,由题意建立如下三段式:
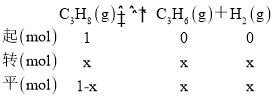
则![]() =0.33,解得x≈0.5,丙烷、丙烯和氢气的分压均为104Pa×
=0.33,解得x≈0.5,丙烷、丙烯和氢气的分压均为104Pa×![]() ,则Kp=
,则Kp=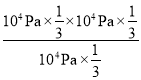 =104Pa×
=104Pa×![]() =3.3×103Pa,故答案为:Ⅰ;3.3×103Pa;
=3.3×103Pa,故答案为:Ⅰ;3.3×103Pa;
(3)①由图可知,反应ⅰ为3C3H8+2CrO3![]() 3C3H6+Cr2O3+3H2O,反应ⅱ为3CO2+Cr2O3
3C3H6+Cr2O3+3H2O,反应ⅱ为3CO2+Cr2O3![]() 2CrO3+3CO,则催化剂为CrO3;
2CrO3+3CO,则催化剂为CrO3;
②由题意可得H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8kJ/mol(a);CO(g)+
O2(g)===H2O(l) ΔH=-285.8kJ/mol(a);CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ/mol(b);C3H8(g)
O2(g)=CO2(g) ΔH=-283.0kJ/mol(b);C3H8(g)![]() C3H6(g)+H2(g) ΔH=+124.3kJ/mol(c)。由盖斯定律可得(c)-(b)+(a),得热化学方程式C3H8(g)+CO2(g)
C3H6(g)+H2(g) ΔH=+124.3kJ/mol(c)。由盖斯定律可得(c)-(b)+(a),得热化学方程式C3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(l),则ΔH=(+124.3kJ/mol)-(-283.0kJ/mol)+(-285.8kJ/mol)=+121.5kJ/mol;
C3H6(g)+CO(g)+H2O(l),则ΔH=(+124.3kJ/mol)-(-283.0kJ/mol)+(-285.8kJ/mol)=+121.5kJ/mol;
③该工艺中碳与CO2反应生成CO,可以有效消除催化剂表面的积炭,维持催化剂活性,故答案为:CrO3;C3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(l) ΔH=+121.5kJ/mol;碳与CO2反应生成CO,脱离催化剂表面。
C3H6(g)+CO(g)+H2O(l) ΔH=+121.5kJ/mol;碳与CO2反应生成CO,脱离催化剂表面。


科目:高中化学 来源: 题型:
【题目】下图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与实验事实不相符的是
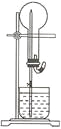
A.CO2(NaHCO3溶液) 无色喷泉B.NH3(H2O含酚酞) 红色喷泉
C.CO2(NaOH溶液) 无色喷泉D.HCl(AgNO3溶液) 白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)
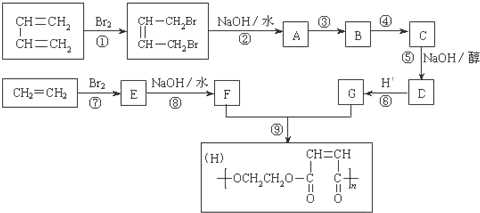
请按要求填空:
(1)写出下列反应的反应类型:反应① ___________ ; 反应⑤ ___________ 。
(2)反应②的化学方程式是:__________ 。
(3)反应③、④中有一反应是与HCl加成,该反应是______(填反应编号),设计这一步反应的目的是_____,物质C的结构简式是_____。
(4)写出与G具有相同种类和数目的官能团的同分异构体:________。
(5)写出由甲苯合成苯甲醛的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.100mol·L—1的NaOH溶液滴加到20mL 0.100mol·L—1的草酸(分子式为H2C2O4,二元弱酸)溶液中,滴加过程中,溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的变化曲线如图所示,下列叙述正确的是
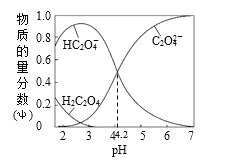
A.电离常数Ka1(H2C2O4)=10—4.2
B.当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-)
C.pH=7.0的溶液中:c(Na+)<2c(C2O42-)
D.当滴入20mLNaOH溶液时:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如黄血盐[K4Fe(CN)6]、普鲁士蓝、血红素等
(1)已知:3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2↑ +2N2↑
①(CN)2分子中σ键和π键的数目比为n(σ)﹕n(π)=____。
②(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2),乙二胺易溶于水,除因为是极性分子外,还可能的原因是____。
(2)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,写出外界离子基态核外电子排布式____。
(3)血红素(如图)是血红蛋白的合成原料之一,血红色中的N原子的杂化类型为____,请用“→”在图中标出Fe2+的配位键_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是( )
A.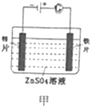 甲图装置可以实现铁片上镀锌
甲图装置可以实现铁片上镀锌
B.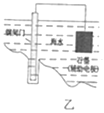 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C.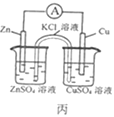 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D.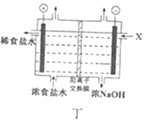 丁图中,X处补充稀NaOH溶液以增强溶液导电性
丁图中,X处补充稀NaOH溶液以增强溶液导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。

下列说法中,正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.放电时,电池的正极反应为MnO2-e-+H+=MnOOH
C.充电时,Zn2+移向MnO2
D.合成有机高聚物的单体是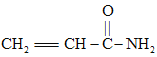
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡巴拉丁F是老年人认知障碍的重要治疗药物。其合成路线如图所示:
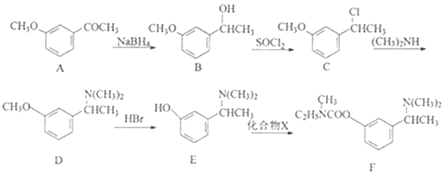
(1)B中含氧官能团的名称为___。
(2)B→C的反应类型为___。
(3)化合物X(C4H3ONCl)的结构简式为__。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式:__。
①能水解,水解产物之一能与FeCl3溶液发生显色反应。
②分子中含有4种不同化学环境的氢。
(5)已知:RX![]() RCN
RCN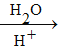 RCOOH
RCOOH
RX+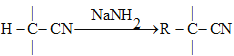
以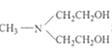 和苯为主要原料制备
和苯为主要原料制备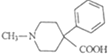 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易粉碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产Ni2O3的工艺流程如下:
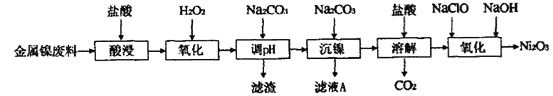
下表为金属离子生成氢氧化物沉淀的pH(设开始沉淀时金属离子浓度为1.0 mol·L-1):
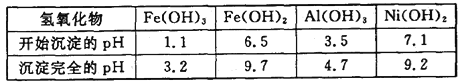
回答下列问题:
(1)为提高金属镍废料浸出的速率,在“酸浸”时可采取的措施是___________。(写两点即可)
(2)酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+、Al3+等。加H2O2的作用是__________,其离子方程式为______________________。
(3)在沉镍前,需加Na2CO3控制溶液pH的范围为__________。
(4)沉镍的离子方程式为_____________________。
(5)氧化生成Ni2O3的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com