
【题目】浓度为2.00mol/L的盐酸溶液1L,欲使其浓度变为4.00mol/L,下列方法可行的是( )
A.蒸发掉0.5L水
B.标况下通入44.8L HCl气体
C.将溶液加热蒸发浓缩至0.5L
D.加入10mol/L盐酸0.6L,再将溶液稀释至2L
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( ) 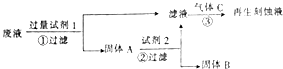
A.试剂1可以是铁也可以是铜
B.试剂2可以是盐酸也可以是硫酸
C.气体C为Cl2 , 不能用H2O2替换
D.步骤①②③中发生的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[Al2(SO4)318H2O].
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下:
步骤1:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中.
步骤2:从导管口7导入干燥的氮气,同时打开导管口l和4放空,一段
时间后关闭导管口7和1;导管口4接装有P2O5的干燥管.
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6
中铝过剩.
步骤4:加热烧瓶6,回流一定时间.
步骤5:将氮气的流动方向改为从导管口4到导管口1.将装有
P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝
蒸馏进入收集器2.
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处
拆下,并立即封闭3处.
(1)步骤1中,铝箔用CCl4浸泡的目的是 .
(2)步骤2操作中,通氮气的目的是 .
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 .
(4)步骤4依据何种现象判断可以停止回流操作 .
(5)步骤5需打开导管口1和4,并从4通入N2的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.卤代烃不属于烃类
C.所有卤代烃都是通过取代反应制得
D.卤代烃都是良好的有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需要吸收能量的是
A.1s22s22p63s1→1s22s22p6
B.3S23P5→3S23P6
C.2Px22py12pz1→2Px12py12pz2
D.2H→H-H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: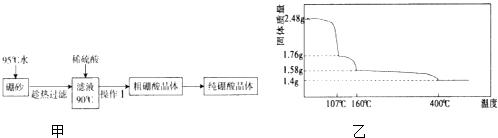
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com