
【题目】根据物质结构和元素周期表的相关知识回答下列问题:
I.用A+、B-、C2-、D表示含有18个电子的离子或分子。请填空:
(1)A元素是__________,B元素是__________,C元素是__________。(用元素符号表示)
(2)物质D由两种元素组成,每个分子中含有三个原子,其电子式表示D形成过程是 _____。
Ⅱ.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
(1)Y在元素周期表中的位置为______,
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ (写化学式)。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物的电子式为________。
【答案】K Cl S H·+ ![]() + ·H →
+ ·H → ![]() 第二周期第ⅥA族 HClO4
第二周期第ⅥA族 HClO4 ![]()
【解析】
I.18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种阳离子K+、Ca2+;阴离子 p3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、 PH3、 SiH4、 F2、H2O2、C2H6、 CH3OH、 N2H4 等。
Ⅱ. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素; X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素; Y、M同主族,可形成MY2、MY3两种分子,所以Y是0元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体)。
I.(1)含有18e-的A+、B-、C2-分别为K+、Cl-、S2-,所以A元素为K,B元素为Cl,C元素为S,故答案为:K;Cl;S。
(2)18e-微粒中由两种元素组成,每个分子中含有三个原子为H2S,用电子式表示形成过程:H·+ ![]() + ·H →
+ ·H → ![]() ,故答案为:H·+
,故答案为:H·+ ![]() + ·H →
+ ·H → ![]() 。
。
Ⅱ.(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第VIA族,故答案为:第二周期第VIA族。
(2) 非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,故答案为:HClO4。
(3)Y和Z的两元素之间形成的原子个数比为1:1的化合物为Na2O2,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.碘水中萃取碘时,往分液漏斗中加入碘水和四氯化碳,充分振荡静置后分液
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D.实验室中的操作类似“海水煮盐”原理的是蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.Al(OH)3难溶于水,不属于电解质B.H2SiO3、H2SO3都是弱酸
C.Na2O2为碱性氧化物D.浓硫酸、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.195g锌粉加入到20.0mL的0.100mol/L的MO2+溶液中,恰好完全反应,则还原产物可能是
A. M2+ B. M C. MO2+ D. M3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
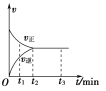
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
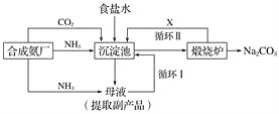

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L的稀硫酸240mL。
(1)选用的主要仪器有:玻璃棒、烧杯、量筒___________________。
(2)需要用量筒量取98%的浓硫酸的体积为_____________;如果实验室有10mL、20mL、50mL的量筒,则所需要的浓硫酸应选用________mL的量筒。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净2-3次并转入容量瓶
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为___________________。
(4)下列操作会使所配的溶液浓度偏大的是_____________(填选项字母)。
A.配制前,量取浓硫酸时发现量筒不干净,用水洗净后直接量取
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,搅拌过程中有液体溅出
C.转入容量瓶前液体未冷却至室温即定容
D.洗涤烧杯和玻璃棒2~3次,洗涤液未转入容量瓶
E.定容时俯视容量瓶的刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com