
【题目】立方烷(C8H8)外观为有光泽的晶体。其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是
A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氯代物1种、二氯代物有3种、三氯代物也有3种
C. 立方烷是棱晶烷(![]() )的同系物,也是环辛四烯的同分异构体
)的同系物,也是环辛四烯的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 0.1molH218O与D2O的混合物中所含中子数为NA
B. 17g羟基所含电子的数目为10NA
C. lLpH=l的H2SO4溶液中含有的H+数目为0.2NA
D. 密闭容器中1molH2(g)与1molI2(g)共热反应制备HI增加2NA个H-I键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是
A. 检验亚硫酸钠试样是否变质:![]()
B. 除去乙酸乙酯中混有的乙酸:![]()
C. 证明酸性条件下H2O2氧化性比I2强:![]()
D. 鉴定盐A的成分是FeBr3:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
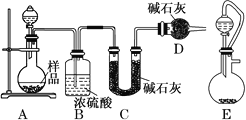
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(1)=2H2O(1)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 该反应的△H<0,△S>0
B. 途径Ⅱ与途径I相比,可能是加了催化剂
C. 其他条件相同时,产生相同体积的氧气时放出的热量:途径I >途径Ⅱ
D. 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
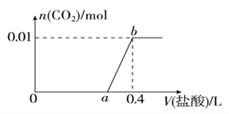
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为________ (阿伏加德罗常数用NA表示),放出的热量为________kJ。
(2)已知:C3H8(g) == CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g) == CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g) === CH3CH=CH2(g)+H2(g)的ΔH=______kJ·mol-1。
(3)甲烷在高温下与水蒸气反应的方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
CO(g)+3H2(g)。部分物质的燃烧热数据如下表:已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式: _______________________________。
物质 | 燃烧热(kJ·mol-1) |
H2(g) | -285.8 |
CO(g) | -283.0 |
CH4(g) | -890.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com