
【题目】下列实验设计能够成功的是
A. 检验亚硫酸钠试样是否变质:![]()
B. 除去乙酸乙酯中混有的乙酸:![]()
C. 证明酸性条件下H2O2氧化性比I2强:![]()
D. 鉴定盐A的成分是FeBr3:![]()
【答案】B
【解析】
A.应先加盐酸,排除亚硫酸根离子的干扰;B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸的酸性比碳酸强;C.稀硝酸具有强氧化性,可氧化NaI;硝酸具有强氧化性,可氧化亚铁离子。
A.若变质生成硫酸钠,应先加盐酸,排除亚硫酸根离子的干扰,再加氯化钡检验硫酸钠的存在,错误;B.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸的酸性比碳酸强,能与碳酸钠反应生成二氧化碳而被吸收,然后分液可得到纯净的乙酸乙酯,正确;C.稀硝酸具有强氧化性,可氧化NaI,应加稀硫酸酸化,错误;FeBr3溶液加HNO3酸化的AgNO3溶液,有可能反应前就是FeBr2或FeBr2和FeBr3的混合液,错误。
故选B。


科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
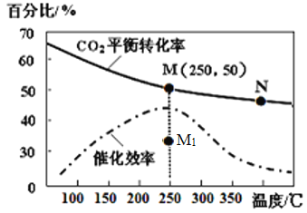
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的[FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为__________,N-N键的键角为__________。
(2)基态砷原子的价电子排布图为__________,砷与同周期相邻元素的第一电离能由大到小的顺序为__________。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是__________(填"PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是__________。S-Cl键键长__________P-Cl键键长__________(填“>”、“=”或“<”),原因是__________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为__________。若该晶体的密度为ρgcm-3,设NA为阿伏加德罗常数的值,则a、b的距离为__________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 盐酸与氨水反应:H++OH-=H2O
B. 铜粉与稀硝酸的反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
D. 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
B. 由分子组成的物质中一定存在共价键
C. 对于平衡2HI(g)![]() I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D. 水的电离是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)外观为有光泽的晶体。其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是
A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氯代物1种、二氯代物有3种、三氯代物也有3种
C. 立方烷是棱晶烷(![]() )的同系物,也是环辛四烯的同分异构体
)的同系物,也是环辛四烯的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2SO3![]() HSO3-+H+ Kal;HSO3-
HSO3-+H+ Kal;HSO3-![]() SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
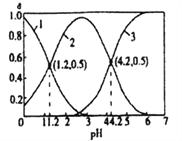
A. 曲线3表示的微粒是SO32-
B. 25℃时,Kal/ Ka2=1000
C. 溶液的pH=1.2时,溶液中有c(Na+)+c(H+)=c(OH-)+c(H2SO3)
D. 溶渡的Ph=4.2时,溶液中有c(Na+)+c(H+)=c(OH-)+2c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是 ( )


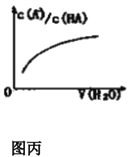
A. 已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);ΔH= - 483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B. 常温下0.2 mol·L-1 HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)> c(Na+)>c(H+)>c(OH-)
C. 常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐减小,且HX的还原性逐渐减弱
D. 图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,![]() 的变化情况
的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com