
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
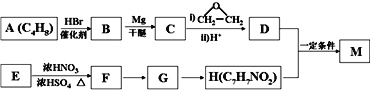
已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
②![]()
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的化学名称是_____。
(2)由E生成F的化学方程式为_____。
(3)由G生成H的反应类型为_____。
(4)M的结构简式为_____。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_____种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6∶1的是_____(写结构简式)。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线_____。
【答案】 2-甲基丙烯 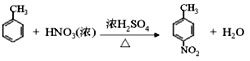 还原反应
还原反应 ![]() 15
15 ![]()
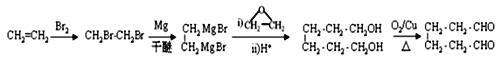
【解析】试题分析:C4H8与HBr反应的产物B只有一种化学环境的氢,说明B是(CH3)3CBr,则A是CH2=C(CH3)2;根据信息②可知,C是(CH3)3CMgBr,D是(CH3)3CCH2CH2OH;M是酯类化合物,所以H含有羧基,H分子式是C7H7NO2,苯环上有两种化学环境的氢,则H是对氨基苯甲酸,结合E→F的反应条件是浓硫酸、浓硝酸的混合物,所以E→F是硝化反应,则E是甲苯、F是对硝基甲苯、G是对硝基苯甲酸。D、H发生酯化反应生成M,则M是![]() 。
。
解析:根据以上分析,(1)A是CH2=C(CH3)2,化学名称是2-甲基丙烯。
(2)甲苯与浓硫酸、浓硝酸的混合物发生硝化反应生成对硝基甲苯的化学方程式为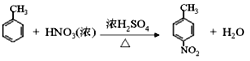 。
。
(3)由对硝基苯甲酸生成对氨基苯甲酸,硝基变为为氨基,所以反应类型为还原反应。
(4)M的结构简式为![]() 。
。
(5)不能与金属钠反应说明没有羟基, (CH3)3CCH2CH2OH的同分异构体中不能与金属钠反应生成氢气有CH3O(CH2)4CH3、CH3OCH(CH3)CH2CH2CH3、CH3OCH2CH(CH3) CH2CH3、CH3OCH2CH2CH(CH3)CH3、CH3OCH(CH2CH3)2、CH3OC(CH3)2CH2CH3、CH3OCH(CH3)CH(CH3)2、CH3OCH2C (CH3)3、CH3CH2OC(CH3)3、CH3CH2O(CH2)3CH3、CH3CH2OCH(CH3)CH2CH3、CH3CH2OCH2CH(CH3)CH3、CH3CH2CH2OCH2CH2CH3、CH3CH2CH2OCH(CH3)2、![]() ,共15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6∶1的是
,共15种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6∶1的是![]() 。
。
(6)乙烯与溴加成生成1,2-二溴乙烷,根据信息②,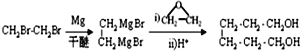 ,用铜作催化剂,
,用铜作催化剂,![]() 氧化为1,6-己二醛,合成路线是
氧化为1,6-己二醛,合成路线是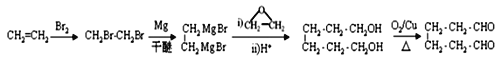


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合溶液中,能观察到的现象是: ①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②纯碱和熟石灰都是碱;③冰和干冰都既是纯净物又是化合物;④盐酸和食醋既是化合物又是酸;⑤豆浆和雾都是胶体。上述说法正确的是( )
A. ①②③ B. ①②⑤ C. ③④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的氢离子浓度0.1molL﹣1 , 则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.气体A中SO2和H2的体积比为4:1
C.反应中共消耗Zn 97.5 g
D.反应中共转移电子3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式________。
,请写出此反应的热化学方程式________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则该电池的正极反应式为________。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。
CH2=CH2(g)+4H2O(g)。已知不同温度对CO2的转化率及催化剂的效率影响如右图所示,下列有关说法不正确的是________(填序号)。

①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5 mol CO和4 mol NO,发生上述(1)中某反应,下图为平衡时NO的体积分数与温度、压强的关系。

回答下列问题:
①温度:T1________T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2 L,则此时的平衡常数K=________(结果精确到两位小数);用CO的浓度变化表示的平均反应速率v(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元索W、X、Y、Z的原子序数依次增加。Z单质是常见的黄绿色气体,u是Y的最高价氧化物且具有两性,v是X的最高价氧化物对应的水化物。常温下,0.01mol·L-1 v溶液的pH为12,0.01 mol·L-1 r溶液的pH为2,上述物质的转化关系如图所示。下列说法正确的是
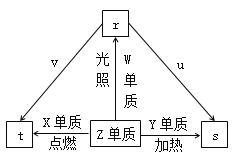
A. 单质沸点:W>Z
B. 原子半径:X>Z>W
C. Y、Z形成的化合物中化学键的类型是离子键
D. X的简单离子比Y的简单离子氧化性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com