
【题目】配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=![]() (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
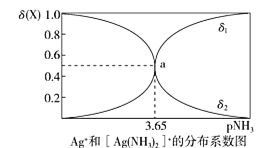
A.图中δ2代表的是δ([Ag(NH3)2]+])B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-)D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3
【答案】B
【解析】
A.向0.1mol/L硝酸银溶液中滴入稀氨水,随着氨水的加入,n(Ag+)逐渐减少,δ([Ag(NH3)2]+)逐渐增大,即δ(Ag+)减少,δ([Ag(NH3)2]+)增加,结合图像变化趋势,δ(Ag+)随着pNH3的增大而增大,所以δ1代表的是δ(Ag+),δ2代表的是δ([Ag(NH3)2]+),A选项正确;
B.NH3与H+反应生成NH4+,使反应Ag++2NH3 ![]() [Ag(NH3)2]+逆向移动,c(Ag+)增大,则δ(Ag+)增大,B选项错误;
[Ag(NH3)2]+逆向移动,c(Ag+)增大,则δ(Ag+)增大,B选项错误;
C.溶液中电荷守恒:c(Ag+)+c([Ag(NH3)2]+)+c(NH4+)+c(H+)=c(OH-)+c(NO3-),物料守恒:c(Ag+)+c([Ag(NH3)2]+) = c(NO3-),两式整理得c(NH4+)+c(H+)=c(OH-),C选项正确;
D.a点时,c(Ag+)=c([Ag(NH3)2]+),pNH3=3.65,则c(NH3)=10-3.65mol/L,K不稳([Ag(NH3)2]+)= c2(NH3)=( 10-3.65)2=10-7.3,D选项正确;
答案选B。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+Br2(g)![]() 2HBr(g)分下列三步进行,有关键能如下表所示:
2HBr(g)分下列三步进行,有关键能如下表所示:

①Br2![]() 2Br(快反应) △H1,K1
2Br(快反应) △H1,K1
②Br+H2![]() HBr+H(慢反应) △H2,K2
HBr+H(慢反应) △H2,K2
③H+Br![]() HBr(快反应) △H3,K3
HBr(快反应) △H3,K3
则下列说法错误的是
A.△H1>△H2>△H3
B.25℃时:K1>K3
C.H2(g)+Br2(g)![]() 2HBr(g)的速率由反应②的速率决定
2HBr(g)的速率由反应②的速率决定
D.H2(g)+Br2(g)![]() 2HBr(g) △H<0
2HBr(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有: K+、 Na+、Clˉ、CO32ˉ、SO42ˉ等离子,将该固体溶解所得到的溶液进行如下实验:

下列说法正确的是
A. 该混合物一定是K2CO3和 NaCl B. 该混合物可能是 Na2CO3和 KCl
C. 该混合物一定是Na2CO3和 NaCl D. 该混合物可能是 Na2SO4和 Na2CO3
【答案】B
【解析】焰色反应呈黄色,说明一定含有Na+;加入过量硝酸钡生成能溶于盐酸的沉淀,原溶液一定含有CO32ˉ,一定不含SO42ˉ;加入过量硝酸钡后的滤液中加入硝酸酸化的硝酸银,生成白色沉淀,则原溶液一定含有Clˉ;根据以上分析,一定含有Na+、Clˉ、CO32ˉ,一定不含SO42ˉ,可能含有K+;所以该混合物可能是 Na2CO3、 KCl或K2CO3、NaCl,故B正确。
【题型】单选题
【结束】
20
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)SO2Cl2(l) H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是

A.乙中盛放的试剂为无水氯化钙
B.制备过程中需要将装置甲置于冰水浴中
C.用来冷却的水应该从a口入,b口出
D.可用硝酸与亚硫酸钠反应制备二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A.向 AgCl 、 AgBr 的饱和溶液中滴加少量 AgNO3 溶液,溶液中![]() 不变
不变
B.向0.1mol L1 的CH3COOH 溶液中加入少量水,溶液中![]() 减小
减小
C.0.1mol K2Cr2O7 被完全还原为Cr3 时,转移的电子数约为1.806 1023
D.一定条件下,反应 2NO(g) 2CO(g) N 2(g) 2CO 2(g) 能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法正确的是()
A.电解精炼铜,当外电路通过 NA 个电子时,阳极质量减小 32 g
B.反应 3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
C.常温常压下 27 克 Al 与 33.6L 氯气完全反应,电子转移数小于 3NA
D.1 mol·L-1 氯化铜溶液中,若 Cl-的数目为 2NA,则 Cu2+的数目略小于 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:

已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com