
【题目】有资料显示过量的NH3和Cl2在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:

(1)岩脑砂的制备
①利用装置A制取实验所需的NH3,写出反应的化学方程式:______。
②已知该实验中用浓盐酸与MnO2反应制取所需Cl2,装罝F中的试剂是饱和食盐水,则F装置的作用是___。
③为了使NH3和Cl2在D中充分混合,请确定上述装置的合理连接顺序:___→e f←h←g←j←i←b(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明NH3和Cl2反应生成的岩脑砂中含有NH4+,需要用到的实验用品中除了蒸馏水、稀HNO3、红色石蕊试纸外,还需要用到的试剂有___。(填试剂的化学式也可以)
(2)岩脑砂中元素的测定:准确称取a g岩脑砂,与足量的氧化铜混合加热,利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。
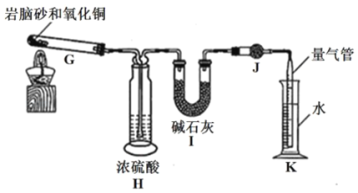
(已知该过程发生的反应为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
⑤设置装置H的目的是___。
⑥若装置I增重b g,利用装置K测得气体体积为V L(已知常温常压下的气体摩尔体积为24.5Lmol﹣1),则岩脑砂中n(N):n(Cl)=___(用含b、V的代数式表示,不必化简)。
⑦若测量体积时气体温度高于常温(其他操作均正确),则n(N)比正常值____(“偏高”“偏低”或“无影响”)。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2 NH3↑+2 H2O 除去Cl2中的HCl气体 a→d→c 氢氧化钠浓溶液 吸收反应产生的水蒸气,防止对HCl测定造成干扰 (2V/24.5):(b/36.5) 偏高
CaCl2+2 NH3↑+2 H2O 除去Cl2中的HCl气体 a→d→c 氢氧化钠浓溶液 吸收反应产生的水蒸气,防止对HCl测定造成干扰 (2V/24.5):(b/36.5) 偏高
【解析】
(1)①实验室制备氨气是利用氯化铵与氢氧化钙共热制得,其化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2 NH3↑+2 H2O;
CaCl2+2 NH3↑+2 H2O;
②浓盐酸具有挥发性,生成的氯气含有HCl,需要除去,饱和食盐水吸收HCl,同时降低氯气在水中溶解度,因而F装置的作用是除去Cl2中的HCl气体;
③根据信息可知b到f为氯气进入D装置,则D装置e端需通入NH3,A装置a端为NH3出口,氨气需干燥,因而通入C干燥管中,其连接顺序为a→d→c;
④铵根离子的检验思路是铵盐与浓碱液共热制得氨气,氨气接触湿润的红色石蕊试纸,若变蓝色,说明岩脑砂中含有铵根,因而还需氢氧化钠溶液。
(2)⑤利用图示装置测定岩脑砂中氮元素和氯元素的物质的量之比,根据该过程发生的反应可知需测量氮气和氯化氢的量,氯化氢可用I碱石灰吸收,碱石灰也能够吸水,因而需加一个干燥装置,即H浓硫酸用来吸收反应产生的水蒸气,防止对HCl测定造成干扰;
⑥根据装置I增重b g,利用装置K测得气体体积为V L(已知常温常压下的气体摩尔体积为24.5Lmol﹣1),可知装置I吸收氯化氢,因而m(HCl)=b g,则n(Cl)=b/36.5mol,装置K利用排水法测量氮气的体积,V(N2)=V L,n(N)=2×V/24.5mol,n(N):n(Cl)=![]() ;
;
⑦其他条件不变,温度越高,气体体积越大,因而根据n(N)=2×V/24.5mol,即V越大,n(N)越大,n(N)比正常值偏高。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是

A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代建筑门框架,常用电解加工成古铜色的硬铝制造。硬铝是
A.Al—Mg合金B.Al—Cu—Mg—Mn—Si合金
C.Al—Si合金D.表面的氧化铝膜的纯铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )

A. 反应的化学方程式为:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
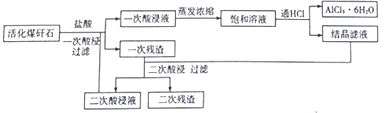
【题目】煤矸石(主要成份是SiO2和Al2O3还含有少量的Fe2O3、K2O、TiO2)活化后,可以制备六水三氯化铝(AlCl3·6H2O),工艺流程如下图所示。
回答下列问题:
(1)焙烧至700℃左右可使煤矸石活化,活化过程中会发生一系列反应,写出SiO2与K2O反应的化学方程式______________,焙烧后的矸石颗粒有微孔,不需研磨成粉即可进行酸溶,原因是_____________。
(2)本工艺的突出特点是通过向饱和溶液中通HCl来得到产品和对一次残渣进行二次酸浸,HCl的作用是_________________和抑制Al3+水解,二次酸浸的目的是___________________。
(3)四轮循环后所得结晶滤液中,含有较多杂质离子,必须在常温下进行如下图所示的处理
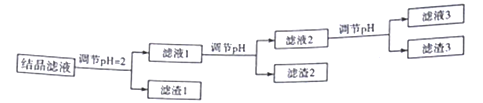
已知:Ksp(Fe(OH)3]=1.0×10-38,Ksp(Al(OH)3]=1.0×10-33,当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全。
滤渣1中所含金属元素为___________,获得滤渣2时,应调节溶液的pH至少为_________,在该流程中,滤渣3可循环使用,则生成滤渣2的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如下所示的是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子。当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是
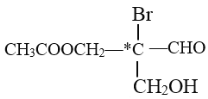
A. 与乙酸发生酯化反应 B. 与NaOH水溶液反应
C. 催化剂作用下与H2反应 D. 与银氨溶液作用只发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com