
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径A>B>D>C | B.原子序数 d > c > b > a |
| C.离子半径C>D>B>A | D.单质的还原性A>B>D>C |
科目:高中化学 来源: 题型:单选题
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A.原子序数:Y>X>Z>W | B.离子半径: X+>Y2+>Z->W2- |
| C.原子最外层电子数:Z>W>Y>X | D.还原性: X>Y W2-> Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列性质的比较正确的是
| A.酸性:H2SiO3>H2CO3 | B.碱性:Mg(OH)2>Al(OH)3 |
| C.稳定性:SiH4>PH3 | D.原子半径:N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是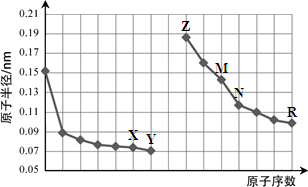
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X > Z > M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质不能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E可能是一种金属元素 |
| B.在ECln中E与Cl之间形成共价键 |
| C.E位于元素周期表的IVA族 |
| D.E的一种氧化物为EO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能说明A元素的非金属性比B元素的非金属性强的是:
| A.A原子得到电子的数目比B原子少 |
| B.A元素的最高正价比B元素的最高正价要高 |
| C.气态氢化物溶于水后的酸性:A比B强 |
| D.A单质能与B的氢化物水溶液反应,生成B单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质。而Z不能形成双原于分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W < X < Y < Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com