
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )

A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【答案】C
【解析】
A、H2SO3为弱酸,a点溶液中含硫的粒子有SO32-、HSO3 -、H2SO3,根据H2SO3的Ka1=c(HSO3-)×c(H+)/c(H2SO3),根据pKa1=lgKa1有Ka1=10-1.85=c(HSO3-)×10-1.85/c(H2SO3),所以c(HSO3-)=c(H2SO3),故A正确;
B、b点加入氢氧化钠溶液的体积为20mL,与H2SO3恰好生成NaHSO3,根据物料守恒有:c(Na+)=c(SO32-)+ c(HSO3-)+ c(H2SO3),根据电荷守恒有:c(OH-)+2c(SO32-)+c(HSO3-)=c(Na+)+ c(H+),所以有:c(OH-)+2c(SO32-)+c(HSO3-)=c(SO32-)+ c(HSO3-)+ c(H2SO3)+c(H+),故c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C、c点加入的氢氧化钠溶液大于20mL小于40mL,所以生成的溶质为Na2SO3和NaHSO3,根据c点溶液中H2SO3的第二步平衡常数,由pKa2=7.19可得Ka2=10-7.19,又根据Ka2=c(SO32-)×c(H+)/c(HSO3-),c(H+)=10-7.19,所以 c(SO32-)=c(HSO3-),又根据电荷守恒有c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以有c(Na+)=c(OH-)+3c(HSO3-)-c(H+),又因为c点呈碱性,c(OH-)>c(H+),所以c(Na+)>3c(HSO3-),故C错误;
D、d点恰好完全反应生成Na2SO3溶液,SO32-水解得到HSO3-,但是水解程度小,故有c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故D正确;
综上所述,本题答案为C。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
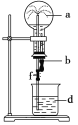
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5:有机化学基础]扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A可发生银镜反应,且具有酸性,A的结构简式为____________。B的分子式为C6H6O,则A与B所发生反应的类型为___________。
(2)C生成D的化学方程式为_____________________________。E是由2分子C生成的含有3个六元环的化合物,E的结构简式为______________。
(3)1 mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。符合下列条件的F的同分异构体(不考虑立体异构)共有______种。
①苯环上只有2个取代基且处于对位,其中一个是羟基;
②在稀H2SO4中或NaOH溶液中加热均能发生水解反应;
③能发生银镜反应。
(4)已知:R—CH2—COOH![]()
![]() ,A有多种合成方法,在下面的空格处写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:
,A有多种合成方法,在下面的空格处写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:
H2C===CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
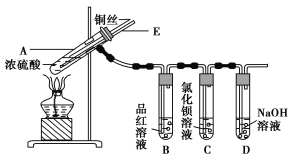
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )

A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
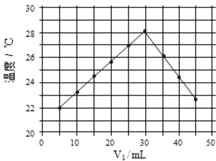
A. 做该实验时环境温度为22℃ B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质都是人类重要的营养物质。回答下列问题:
(1)淀粉和纤维素是两种重要的多糖,这两种物质________(填“能”或“不能”互称为同分异构体,淀粉完全水解的化学方程式为______________。
(2)在常温常圧下、油脂既有呈固态的,也有呈液态的。某液态油脂的一种成分的结构简式为 ,则该油脂______(填“能”或“不能”)使溴水褪色,该油脂在热NaOH溶液中水解的产物有C17H35COONa、C17H33COONa、_____________。
,则该油脂______(填“能”或“不能”)使溴水褪色,该油脂在热NaOH溶液中水解的产物有C17H35COONa、C17H33COONa、_____________。
(3)发育出现障碍,患背养缺乏症,这主要是由摄入蛋白质不足引起的。蛋白质在人体内水解的最终产物是_______;向蛋白质溶液中加入(CH3COO)2Pb溶液会出现白色沉淀,该变化叫作_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
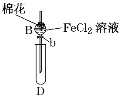
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com