
【题目】[选修5:有机化学基础]扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A可发生银镜反应,且具有酸性,A的结构简式为____________。B的分子式为C6H6O,则A与B所发生反应的类型为___________。
(2)C生成D的化学方程式为_____________________________。E是由2分子C生成的含有3个六元环的化合物,E的结构简式为______________。
(3)1 mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为_______mol。符合下列条件的F的同分异构体(不考虑立体异构)共有______种。
①苯环上只有2个取代基且处于对位,其中一个是羟基;
②在稀H2SO4中或NaOH溶液中加热均能发生水解反应;
③能发生银镜反应。
(4)已知:R—CH2—COOH![]()
![]() ,A有多种合成方法,在下面的空格处写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:
,A有多种合成方法,在下面的空格处写出由乙酸合成A的路线流程图(其他原料任选)。合成路线流程图示例如下:
H2C===CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5
_________________________________________________________。
【答案】 OHC-COOH 加成反应 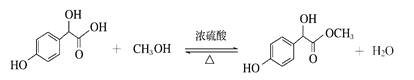
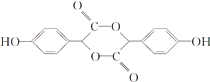 3 4
3 4 ![]()
【解析】A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,C和甲醇发生酯化反应生成D,根据D的结构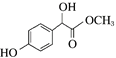 反推C的结构为
反推C的结构为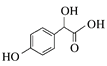 ,根据C的结构可知B是
,根据C的结构可知B是![]() ,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为
,A+B→C发生加成反应;C和甲醇反应生成D和副产物E,E是由2分子C生成的含有3个六元环的化合物,根据D结构简式知,E为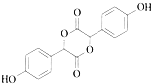 ;D发生取代反应生成F;
;D发生取代反应生成F;
(1)A的结构简式为OHC-COOH,OHC-COOH和![]() 发生加成反应生成
发生加成反应生成 ,故本题答案为:OHC-COOH;加成反应;
,故本题答案为:OHC-COOH;加成反应;
(2)C和甲醇发生酯化反应生成D,化学方程式为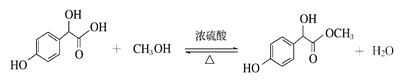 。
。
2分子 分子间酯化形成六元环酯E,则E的结构简式为
分子间酯化形成六元环酯E,则E的结构简式为 ;
;
(3)F中酚羟基、酯基水解生成的羧基、溴原子被取代生成的HBr都能和NaOH反应,1mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为:3mol;
F为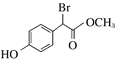 ,对应的同分异构体①苯环上只有2个取代基且处于对位,其中一个是羟基②在稀H2SO4中或NaOH溶液中加热均能发生水解反应,说明含有酯基和溴原子③能发生银镜反应,应为甲酸酯,可能的结构有
,对应的同分异构体①苯环上只有2个取代基且处于对位,其中一个是羟基②在稀H2SO4中或NaOH溶液中加热均能发生水解反应,说明含有酯基和溴原子③能发生银镜反应,应为甲酸酯,可能的结构有
![]() 、
、![]() 、
、![]() 、
、![]() ,共4种
,共4种![]() 为苯环),因此,本题正确答案是: 3;4;
为苯环),因此,本题正确答案是: 3;4;
(4)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH,合成路线流程图为:CH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOH,
OHC-COOH,
故答案为:CH3COOH![]() ClCH2COOH
ClCH2COOH![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHC-COOH。
OHC-COOH。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③该溶液的焰色反应没有黄色;
④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
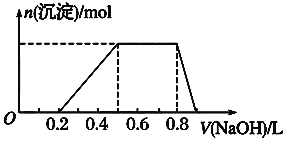
(1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。
(2)肯定不含的离子是_________________________________。
(3)不能确定的离子是_________,如何证明该离子是否存在?__________。
(4)请写出沉淀溶解过程的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌棒和铜棒插入西红柿中,电流表指针发生偏转,如图所示,下列说法正确的是( )

A. 负极反应为Zn-2e-==Zn2+
B. 该装置将化学能转化为电能
C. 电流由锌通过导线流向铜棒
D. 一段时间后,锌棒质量会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应为放热反应的( )
①CaCO3分解 ②钠与水反应 ③硫在O2中燃烧 ④8个结晶水的氢氧化钡与氯化铵的反应 ⑤CaO+H2O=Ca(OH)2 ⑥N2与H2合成NH3 ⑦NaOH和CH3COOH的反应
A. ①②③B. ④⑤⑦C. ④⑦⑧D. ②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )

A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式可进一步简化,如:
CH3CH2CH2CH3: 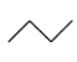 ,
,![]() :
: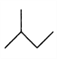 ,CH3CH=CHCH3 :
,CH3CH=CHCH3 :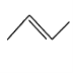
(1)写出下列有机物的结构简式:
2,2,3,3-四甲基戊烷:____________________;
3,4-二甲基-4-乙基庚烷:____________________。
(2)写出下列物质的分子式:
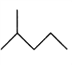 :__________________________;
:__________________________;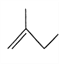 :__________________________。
:__________________________。
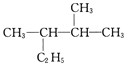
(3)用系统命名法命名下列物质:
![]() ____________________。
____________________。
 ____________________。
____________________。
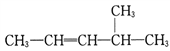 ____________________。
____________________。
![]() ____________________。
____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com