
����Ŀ���������-��(III)���K3 [Fe(C2O4)3]��3H2O (Mr=491)Ϊ��ɫ���壬������ˮ���������Ҵ����л��ܼ���110���¿�ʧȥ�ᾧˮ��230��ʱ���ֽ⣬���Ʊ������ͻ�������������Ҫԭ�ϡ������������Ϊԭ���Ʊ����������(III)��ؾ��������������ʾ��

��ش��������⣺
(1)ʵ������Ҳ����Fe3+�δ���������������Ʊ��þ��壬�����ü�Һ����Fe3+������ͬŨ�ȵ�NaOH��Һ��ˮͨ����ͬ������������ѡ��______�ܻ�ÿ����ϴ��Fe(OH)3��
(2)���������в���ˮԡ���ȣ���������¶�Ϊ40�棬������_______��������Ӧ�Ļ�ѧ����ʽΪ_______��������ȫ���轫������Һ��У�Ŀ����__________________��
(3)���ڹ���X������˵���в���ȷ����________________��
A.�ɲ�����ȴ������Һ�м����Ҵ��ķ�����ʹ��������
B��Ϊ�˿��ٵõ��ϸ���Ĺ��壬���Բ��ó��˵ķ���
C��ϴ�Ӿ���ʱ������������ˮϴ�������Ҵ�ϴ
D�����ü��Ⱥ�ɵķ����õ��ϸ���ľ���
��4��Ϊ�˷�����Ʒ���ȣ��������²�����
ȷ��ȡ��Ʒ0.9350g�����Ƴ�250mL��Һ��ÿ����ȡ25.00mL������ƿ�У���������ϡH2SO4�ữ����C2O42-ת��ΪH2C2O4����0.0100mol/LKMnO4��Һ�ζ����յ㣬������_______��ƽ�вⶨ���Σ�����KMnO4������ֱ�Ϊ20.02mL��19.98mL��20.00mL�������ôֲ�Ʒ�Ĵ���Ϊ_________________��(��֪��5 H2C2O4+2 MnO4-+6H+=10CO2��+2Mn2++8H2O)
���𰸡���ˮ�¶�̫�ͣ���Ӧ����̫�����¶�̫�ߣ�H2O2��ֽ�6FeC2O4+6K2C2O4+3H2O2=4K3[Fe(C2O4)3]+2Fe(OH)3����ȥ������H2O2D��Һ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��87.52%
�����������⿼�鹤�����̣��ӻ�ѧ��Ӧԭ����֪ʶ���֣���1��NaOH����ǿ�NH3��H2O���������Һ��c(OH��)��С���γ������������������������γɽϴ��������ѡ��ˮ����2��H2O2�����ֽ⣬�¶ȸߣ���������ֽ⣬����¶ȹ��ͣ���Ӧ�������������������̵�������FeC2O4��K2C2O4��H2O2����������Fe(OH)3��K3[Fe(C2O4)]3����Ӧ�ǣ�FeC2O4��K2C2O4��H2O2��Fe(OH)3��K3[Fe(C2O4)]3��FeC2O4��Fe�Ļ��ϼ��ɣ�2������3�ۣ����ϼ�����1�ۣ�H2O2�����ɣ�1������2�ۣ����ϼ۽���1�ۣ�������2�ۣ�Ȼ�����ԭ���غ���ƽ��������6FeC2O4+6K2C2O4+3H2O2=4K3[Fe(C2O4)3]+2Fe(OH)3������H2O2��������е�Ŀ���dz�ȥ������H2O2����3��A���õ������Ǵ��нᾧˮ������ʱ��������ȴ�ķ����� �����������ز������Ҵ���ʹ���Ҵ��������������������ܽ⣬ʹ֮��������˵����ȷ��B��Ϊ�˿��ٵõ��ϸ���Ĺ��壬���Բ��ó��˵ķ��������ٽᾧˮ����ʧ����˵����ȷ��C�����Ҵ�ϴ�ӣ����������������ص���ʧ��ͬʱ�Ҵ��ӷ�����˵����ȷ��D���ü��ȵķ�����ɣ�������ɾ���ʧȥ�ᾧˮ����˵������4�������ǣ��������һ����Һ����Һ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��ƽ�����ĵ�KMnO4�����Ϊ(20.02��19.98��20.00)/3mL=20.00mL���������ӷ�Ӧ����ʽ����Ʒ�о��������Ϊ��20.00��10��3��0.0100��5��491��250/(2��25��3)g=0.8183g����������Ϊ0.8183/0.9350��100%=87.52% ��


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȵ���Ƭ��ͭƬ�õ�����������500mL����ͭ��Һ�й�����ͼ1��װ�ã�
�����¾����跴Ӧ��������Һ������䣩��
��1����Ƭ�ϵĵ缫��ӦʽΪ______________��ͭƬ��Χ��Һ�����___________������
��2����2 min������Ƭ��ͭƬ֮���������Ϊ1.2g�����㣺�����������ĵ��ӵ����ʵ���Ϊ_________________mo1��
��3�������ĵ绯ѧ��ʴ�ı������γ���ԭ��ء�����ͼ��ʾ���ձ��ж�ʢ��ϡ���ᡣ


��ͼ2 B�е�SnΪ________����Sn��������Һ��pH��������С�䣩___________��
��ͼ2 C�б���ʴ�Ľ�����___________���Ƚ�A��B��C�д�������ʴ�������ɿ쵽����˳����______��
��4������Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ��ȼ�ϵ����һ�ָ�Ч�������ѺõĹ���װ�ã���ͼ�ǵ����Ϊϡ������Һ������ȼ�ϵ��ԭ��ʾ��ͼ���ش��������⣺

������ȼ�ϵ�ص��ܷ�Ӧ��ѧ����ʽ�ǣ�___________________��
����ع���һ��ʱ���������Һ��Ũ��_____________������������������С����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����ʵ����̽�������й�����,�������ͼ��ʾʵ��,A�������巢��װ��,A�����õ�ʵ��ҩƷ������������ѡȡ����̼���ơ���̼�����ơ���̼����李����Ȼ�李�����ʯ�ҡ�����������

����ͼ���Ӻø�����,�Ƚ�C���IJ�˿������������,�ٽ�A������������ͨ��Bװ��Ƭ�̺�ȥC���ƾ���,����ʵ�����������:��˿�������ֺ���״̬,D�е�ͭƬ�����ܽ⡣�ش���������:
(1)��A����ȡ����ʱֻ����һ��ҩƷ,���ҩƷ��___________(���������)��
(2)Bװ�õ�����Ϊ________________________��
(3)C�з�����Ӧ�ķ���ʽΪ________________________��
(4)ͼE�г���ͨ������������Ϊ_______________________��
(5)������Ϊ������Ƶ�����ʵ��װ�û��������ԵIJ���,���䲻��֮���Լ�Ӧ��θĽ�,̸̸������:______________��
(6)��֪NH3������CCl4��������װ���У������������հ���������_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ե���ɫ����Һ���ܹ�����������ǣ� ��
A.NH4+��Fe3+��SO42����Cl��
B.Mg2+��Ag+��CO32����Cl��
C.K+��NH4+��SO42����Cl��
D.K+��Na+��NO3����HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ȼ�߷��ӻ��������( )
A. ���� B. ���� C. ��֬ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ݻ�һ�����ܱ������У������еĿ��淴Ӧ��A(g)+B(g)![]() xC(g)����ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ����(T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾC���������)
xC(g)����ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ����(T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾC���������)
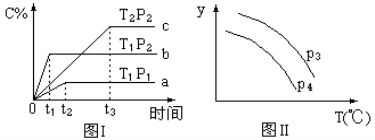
A��P3��P4��y���ʾC�ĺ���
B��P3��P4��y���ʾB���������
C��P3��P4��y���ʾ���������ܶ�
D��P3��P4��y���ʾ��������ƽ��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A. ������������� B. ���ά����Ҫ�ɷ��ǹ�����
C. ��������һ��ǿ�� D. �Ƶ���ɫΪdz��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ˮ�п��ܺ���NH4+��Fe2+��Cl-��Fe3+��SO42-��HCO3-�����е�һ�ֻ��֣�Ϊ�����������ӣ�ij��ȤС�����������ʵ�鷽������ش��������⣺

����˵����ȷ����
A. ����ˮ��һ������Fe3+��������Fe2+ B. ����lΪBaCO3��BaSO4
C. ����2����ΪAgCl��Ag2SO4 D. ����ˮ��һ������NH4+��Cl-��Fe3+��SO42-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ص������۱�������ָ��λ�����ĵ缫�������������ͷŵ������ܡ�������(M)���������������ͼ������ԭ���á������ܶȸߵ��ŵ㡣�����طŵ���ܷ�Ӧ����ʽΪ��4M+nO2+2nH2O=4M(OH) n������˵������ȷ����

A. ������(M)����������ŵ���̵�������Ӧʽ�� O2+2H2O+4e-=4OH-
B. �Ƚ�Mg��Al��Zn�������������������������Al����������������۱��������
C. �������Һ�е������ӴӸ���������������
D. ����M������������У�Ϊ��ֹ����������Mg(OH)2���˲������Ե���ʼ������ӽ���Ĥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com