
| A. | c(H+)+c(NH4+ )=c(OH- )+c(HCO3-)+2c(CO32-) | |
| B. | c(Na+ )=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
分析 A.根据混合液中的电荷守恒进行计算;
B.根据物料守恒即c(Na)=c(C)分析;
C.根据Kw=c(H+)×c(OH-)=1.0×10-14计算;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),HCO3-的电离程度很小.
解答 解:A.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),由于析出部分NaHCO3晶体,则c(Na+)<c(Cl-),所以c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.溶液中存在物料守恒,即:c(Na)=c(C),则:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.水的离子积为:Kw=c(H+)×c(OH-)=1.0×10-14,已知pH<7,则c(H+)>1.0×10-7mol/L,所以$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L,故C正确;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3-浓度减小,HCO3-的电离程度很小,所以c(CO32-)最小,即c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-),故D正确;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒即盐的水解原理的含义为解答关键,注意熟练掌握判断离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该硫酸铜晶体体积增大 | D. | 溶液的蓝色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
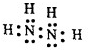
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
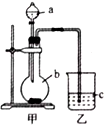 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和H2全部转化为NH3 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| D. | 若外界条件发生改变,化学反应的限度可能随之改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com