

| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |


科目:高中化学 来源: 题型:
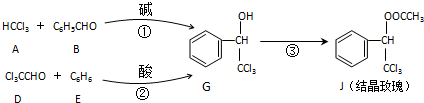
| KOH |
 +
+
| 酸 |
 +H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为
+H2O,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
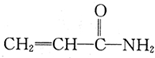 .下列相关分析正确的是( )
.下列相关分析正确的是( )| A、电负性:C<N<O |
| B、该分子中σ键与π键数目之比为4:2 |
| C、该分子所有原子处于同一平面 |
D、该分子的加聚产物为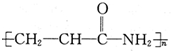 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定没有CO2,肯定有H2 |
| B、一定有CO、CO2和水蒸气? |
| C、一定有H2、CO2和HCl |
| D、可能有CO2、NH3和水蒸气? |
查看答案和解析>>
科目:高中化学 来源: 题型:
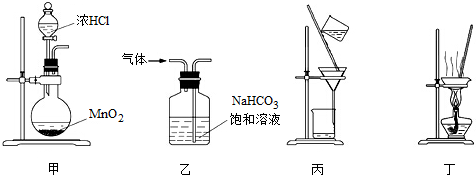
| A、用装置甲制取氯气 |
| B、用装置乙除去氯气中混有的少量氯化氢 |
| C、用装置丙分离二氧化锰和氯化锰溶液 |
| D、用装置丁蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com