
【题目】酯类常用作香料。某酯H的合成路线如下:
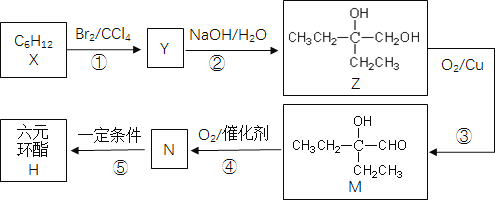
回答下列问题:
(1)X的名称是______。M中所含官能团的名称是______。
(2)①的反应类型是_____。X的加聚反应产物的结构简式为__。
(3)X含有相同官能团的同分异构体有多种,其中有一种的核磁共振氢谱只有一组吸收峰,其结构简式是__。
(4)写出反应②的化学方程式:_______。
(5)H的结构简式是_______。
【答案】2-乙基-1-丁烯 羟基、醛基 加成反应 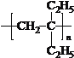
![]()
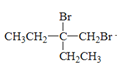 +2NaOH
+2NaOH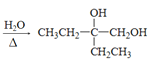 +2NaBr
+2NaBr 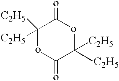
【解析】
X到Y是加成反应,Y到Z是卤代烃的水解,Z到M是醇的催化氧化,M到N也是催化氧化,N到H是酯化反应。
⑴根据Z分析出Y到Z是卤代烃水解,并推断出Y的结构,继而推出X的结构为
(CH3CH2)2C=CH2,因此X的名称为2-乙基-1-丁烯,M中所含官能团的名称是羟基和醛基,
故答案为2-乙基-1-丁烯;羟基、醛基;
⑵X是烯烃与溴单质加成,因此①的反应类型是加成反应,X的加聚反应产物的结构简式为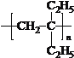 ,
,
故答案为加成反应;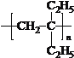 ;
;
⑶X含有相同官能团的同分异构体有多种,其中有一种的核磁共振氢谱只有一组吸收峰,说明碳碳双键两边是一样的结构,其结构简式是![]() ,
,
故答案为![]() ;
;
⑷反应②是卤代烃在碱性条件下水解,其化学方程式: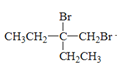 +2NaOH
+2NaOH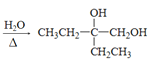 +2NaBr,
+2NaBr,
故答案为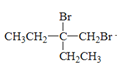 +2NaOH
+2NaOH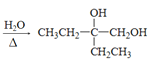 +2NaBr;
+2NaBr;
⑸两分子的N发生酯化反应生成环状的H,其结构简式是 ,
,
故答案为 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )
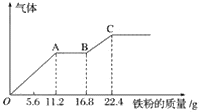
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL![]() 盐酸跟50mL
盐酸跟50mL![]() NaOH溶液中和反应过程中所放出的热量计算中和热。
NaOH溶液中和反应过程中所放出的热量计算中和热。
(1)烧杯间填满泡沫塑料的作用是______;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______![]() 填“偏大”、“偏小”、“无影响”
填“偏大”、“偏小”、“无影响”![]()
(3)如图所示,仪器A的名称是______;

(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
已知:![]() ,反应后溶液的比热容c为
,反应后溶液的比热容c为![]() ,各物质的密度均为
,各物质的密度均为![]() 。计算
。计算![]() ______
______![]()
(5)实验中改用80mL![]() 盐酸跟100mL
盐酸跟100mL![]() NaOH溶液进行反应,与上述实验相比,所放出的热量______
NaOH溶液进行反应,与上述实验相比,所放出的热量______![]() 填“相等、“不相等”
填“相等、“不相等”![]() ,所求中和热______
,所求中和热______![]() 填“相等、“不相等”
填“相等、“不相等”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苄酯是一种有馥郁茉莉花香气的无色液体,沸点213 ℃,密度为1.055 g·cm-3,实验室制备少量乙酸苄酯的反应如下:CH2OH+(CH3CO)2O![]() CH2OOCCH3(乙酸苄酯)+CH3COOH
CH2OOCCH3(乙酸苄酯)+CH3COOH
实验步骤如下:
步骤1:三颈烧瓶中加入30 g (0.28 mol)苯甲醇、30 g乙酸酐(0.29 mol)和1 g无水CH3COONa,搅拌升温至110 ℃,回流4~6 h(装置如图所示):
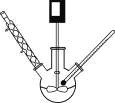
步骤2:反应物降温后,在搅拌下慢慢加入15%的Na2CO3溶液,直至无气泡放出为止。
步骤3:将有机相用15%的食盐水洗涤至中性。分出有机相,向有机相中加入少量无水CaCl2处理得粗产品。
步骤4:在粗产品中加入少量硼酸,减压蒸馏(1.87 kPa),收集98~100 ℃的馏分,即得产品。
(1) 步骤1中,加入无水CH3COONa的作用是_______________,合适的加热方式是_______。
(2) 步骤2中,Na2CO3溶液需慢慢加入,其原因是____________。
(3) 步骤3中,用15%的食盐水代替蒸馏水,除可减小乙酸苄酯的溶解度外,还因为_______________;加入无水CaCl2的作用是___________________。
(4) 步骤4中,采用减压蒸馏的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如下:
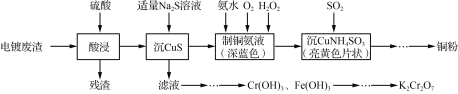
(1) “酸浸”时,用硫酸而不用盐酸,这是因为______________(从浸取产物的溶解性考虑)。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用8 mol·L-1氨水,适量30% H2O2,并通入O2,控制温度为55 ℃。温度不宜过高,这是因为______________________。
(3) “沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):
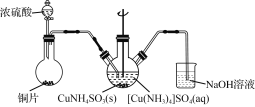
①制取SO2的化学方程式为______________________。
②“沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是________________。
③反应完成的实验现象是____________________________。
(4) 设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,_________________,冰水洗涤及干燥。
(已知:①碱性条件下,H2O2可将+3价的Cr氧化为CrO42-;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以Cr2O72-的形式存在;在pH>7时,主要以CrO42-的形式存在。
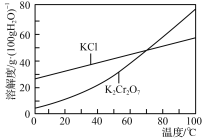
②部分物质溶解度曲线如图所示:
③实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v (丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA 族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______(填序号)
a.Cl2、Br2、I2 的熔点 b.Cl2、Br2、I2 的氧化性
c.HCl、HBr、HI 的热稳定性 d.HCl、HBr、HI 的酸性
(2)工业上,通过如下转化可制得 KClO3 晶体:
NaCl溶液![]() NaClO3
NaClO3![]() KClO3晶体
KClO3晶体
①完成 I 中反应的总化学方程式:_______NaCl+________H2O =_______NaClO3+_______。
②反应Ⅰ中 NaClO3 是_______极(选填“阴”或“阳”极)产物。
③Ⅱ中转化的基本反应类型是_________,该反应过程能析出 KClO3 晶体而无其它晶体析出的原因是_______。
(3)一定条件,在水溶液中 1 mol Cl-、ClOX-(x=1,2,3,4)的能量(kJ)相对大小如图所示。
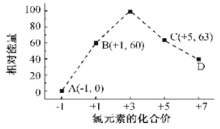
①D 是_______(填离子符号)。
②B→A+C 反应的离子方程式为_______;生成 1mol C 时,________(填吸收或放热)________kJ 的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体的合成路线如下![]() 下列说法正确的是()
下列说法正确的是()
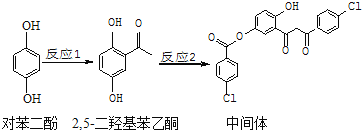
A.对苯二酚在空气中能稳定存在
B.1mol该中间体最多可与11![]() 反应
反应
C.2,![]() 二羟基苯乙酮能发生加成、取代、缩聚反应
二羟基苯乙酮能发生加成、取代、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:![]() 已达平衡的是( )
已达平衡的是( )
A.混合气体的密度B.混合气体的压强
C.![]() 的物质的量浓度D.混合气体的平均相对分子质量
的物质的量浓度D.混合气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com