
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如下:
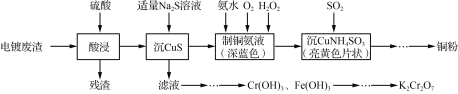
(1) “酸浸”时,用硫酸而不用盐酸,这是因为______________(从浸取产物的溶解性考虑)。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,采用8 mol·L-1氨水,适量30% H2O2,并通入O2,控制温度为55 ℃。温度不宜过高,这是因为______________________。
(3) “沉CuNH4SO3”时可用如下装置(夹持、加热仪器略):
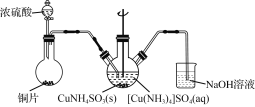
①制取SO2的化学方程式为______________________。
②“沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是________________。
③反应完成的实验现象是____________________________。
(4) 设计以“Cr(OH)3、Fe(OH)3”的混合物为原料,制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,_________________,冰水洗涤及干燥。
(已知:①碱性条件下,H2O2可将+3价的Cr氧化为CrO42-;酸性条件下,H2O2可将+6价的Cr还原为+3价的Cr;+6价的Cr在溶液pH<5时,主要以Cr2O72-的形式存在;在pH>7时,主要以CrO42-的形式存在。
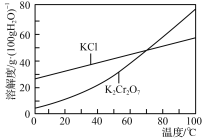
②部分物质溶解度曲线如图所示:
③实验中必须使用的试剂:KOH溶液、10%H2O2溶液、稀盐酸)
【答案】硫酸可将CaO转化为CaSO4渣而除去 温度过高会加速NH3的挥发、加速H2O2的分解、“铜氨液”会分解生成Cu(OH)2(答出一点即可) Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 45 ℃的水浴加热 上层清液由深蓝色逐渐变为几乎无色 在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤
CuSO4+SO2↑+2H2O 45 ℃的水浴加热 上层清液由深蓝色逐渐变为几乎无色 在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤
【解析】
电镀废渣(Cr2O3、CuO、Fe2O3及CaO)用硫酸酸浸,残渣为CaSO4 等溶解度不大的物质,溶液中有Cr3+、Cu2+、Fe3+,加适量Na2S 溶液,过滤,滤液中Cr3+、Fe3+,处理生成Fe(OH)3 Cr(OH)3,除去Fe(OH)3,制备K2Cr2O7;滤渣CuS沉淀,采用8 mol·L-1氨水,适量30% H2O2,并通入O2,制取铜氨溶液,通SO2,“沉CuNH4SO3”,同时生成铜粉。
(1) “酸浸”时,用硫酸而不用盐酸,这是因为硫酸可将CaO转化为CaSO4渣而除去。
(2) “制铜氨液”,即制取[Cu(NH3)4]SO4溶液时,温度不宜过高,这是因为 温度过高会加速NH3的挥发、加速H2O2的分解、“铜氨液”会分解生成Cu(OH)2(答出一点即可);
(3) ①铜与浓硫酸加热生成SO2、硫酸铜和水,化学方程式为 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 。
CuSO4+SO2↑+2H2O 。
②要控制100℃以下的加热温度,且受热均匀,可选用水浴加热;“沉CuNH4SO3”时,反应液需控制在45 ℃,合适的加热方式是:45 ℃的水浴加热。
③[Cu(NH3)4]SO4溶液呈蓝色,通入SO2 反应生成CuNH4SO3和Cu,反应完成的实验现象是上层清液由深蓝色逐渐变为几乎无色。
(4) 制取K2Cr2O7的实验方案:将Cr(OH)3、Fe(OH)3的混合物加入烧杯中,加适量的水调成浆状,在不断搅拌下加入适量KOH溶液,再加入过量的10% H2O2溶液,维持pH大于7,充分反应后,煮沸(除去过量的H2O2),静置、过滤,滤液用稀盐酸酸化至pH<5,蒸发浓缩、冰浴冷却结晶、过滤,冰水洗涤及干燥。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
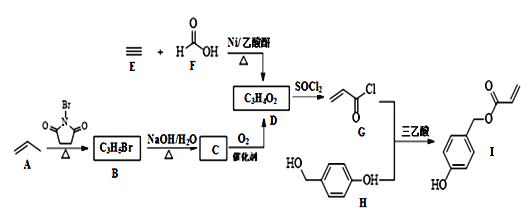
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取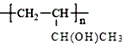 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
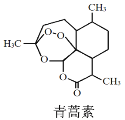
【题目】青蒿素一般是从青蒿中提取,也可进行化学合成,其中的一种合成方法如下:

![]()
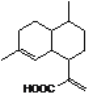
![]()
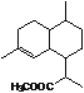
![]()
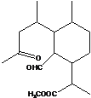
![]()
① ② ③ ④
下列说法正确的是
A.化合物①的分子式为C10H17O
B.化合物②和③互为同分异构体
C.化合物④中含有3种含氧官能团
D.利用青蒿研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型碳可表示为![]() 。试回答下列问题:
。试回答下列问题:
(1)甲基蜂花烯(CH3-C≡C-C≡C-C≡C-H)中含有线型碳结构,下列有关甲基蜂花烯的说法不正确的是__。
a. 甲基蜂花烯分子中所有碳原子一定位于同一直线上
b. 甲基蜂花烯能使溴水和酸性高锰酸钾溶液褪色
c. 与甲基蜂花烯互为同分异构体且含有3个碳碳三键的有机物只有1种
d. 甲基蜂花烯与乙炔互为同系物
(2)将某线型碳与一定量的氢气加成可得到C400H400,则C400H400中碳碳三键最多有__个。
(3)利用激光诱导聚1 , 2-二氯乙烯,脱去HCl可得到线型碳。试以碳化钙为原料制备聚1 , 2-二氯乙烯,其他试剂任选,写出反应的化学方程式______、____、_____。
(4)利用Glaser反应也可以合成线型碳:2 R-C≡C-H![]() R-C≡C-C≡C-R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2。该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
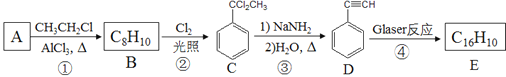
写出以苯乙醇(![]() )为原料(其他无机试剂任选),制备化合物D的合成路线:______。(用结构简式表示有机物。如:A
)为原料(其他无机试剂任选),制备化合物D的合成路线:______。(用结构简式表示有机物。如:A![]() B
B![]() ……)。
……)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类常用作香料。某酯H的合成路线如下:
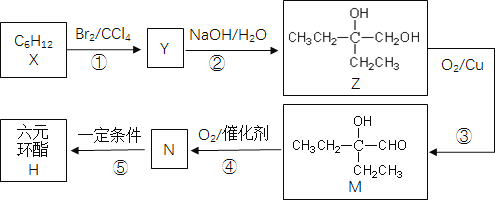
回答下列问题:
(1)X的名称是______。M中所含官能团的名称是______。
(2)①的反应类型是_____。X的加聚反应产物的结构简式为__。
(3)X含有相同官能团的同分异构体有多种,其中有一种的核磁共振氢谱只有一组吸收峰,其结构简式是__。
(4)写出反应②的化学方程式:_______。
(5)H的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度
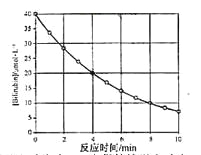
随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
A.2.5μmol·L-1·min-1和2.0 μmol·L-1
B.2.5μmol·L-1·min-1和2.5 μmol·L-1
C.3.0μmol·L-1·min-1和3.0 μmol·L-1
D.5.0μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com