
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp [Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)= 1.8×10-5,下列叙述不正确的是
A. Mg(OH)2、Fe(OH)3的饱和溶液中c(OH-)的大小顺序:Mg(OH)2>Fe(OH)3,25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀,
B. 25℃时,加大量水稀释氨水,电离程度增大,溶液pH减小
C. 25℃时,NH4++H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
D. 将0.02 molL-1MgCl2溶液和0.02 molL-1NaOH溶液等体积混合,没有沉淀生成
【答案】D
【解析】A. Mg(OH)2、Fe(OH)3的饱和溶液中c(OH-)的大小顺序:Mg(OH)2>Fe(OH)3,25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀,故A正确;B. 25℃时,加大量水稀释氨水,电离程度增大,溶液pH减小,故B正确;C. 25℃时,NH4++H2O![]() NH3·H2O+H+的平衡常数为Kh= Kh=
NH3·H2O+H+的平衡常数为Kh= Kh=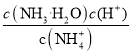 =
=![]() =5.6×10-10,故C正确;D. 将0.02 molL-1MgCl2溶液和0.02 molL-1NaOH溶液等体积混合,c(OH-)= c(Mg2+)= 0.01 molL-1,离子积Qc= c(Mg2+) c(OH-)2=10-6> Ksp[Mg(OH)2],有沉淀生成,故D不正确。故选D。
=5.6×10-10,故C正确;D. 将0.02 molL-1MgCl2溶液和0.02 molL-1NaOH溶液等体积混合,c(OH-)= c(Mg2+)= 0.01 molL-1,离子积Qc= c(Mg2+) c(OH-)2=10-6> Ksp[Mg(OH)2],有沉淀生成,故D不正确。故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
A.6个120° B.5个108° C.4个109°28′ D.6个109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱电解质的电离平衡常数:
酸或碱 | 电离常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | CaCO3 | 5×10-9 |
NH3·H2O | 1.8×10-5 |
请回答下面问题:
(1)上述四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”“中性”或“碱性”),理由是 , 溶液中各离子浓度大小的关系是。
(3)物质的量1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.01mol·L-1以上,则溶液中CO32-物质的量浓度应 ≥mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂操作可行的是( )
A.通过浓硫酸除去SO2中的H2OB.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2D.通过碱石灰除去O2中的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
物质 | Cu(OH)2蓝色 | Fe(OH)3红褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl2·2H2O晶体,加入 , 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2 , 原因是(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
可选用作滴定指示剂,滴定终点的现象是。
CuCl2溶液与KI反应的离子方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的化学性质叙述:①钠与水剧烈反应生成氢氧化钠和氢气;②钠在空气中燃烧时生成白色固体过氧化钠;③钠与盐酸反应时先与酸反应,过量的钠再与水反应;④钠是金属,不溶于水也不和水反应;⑤钠可从硫酸铜溶液中置换出铜。正确的是( )
A.④⑤B.②③C.①②D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )
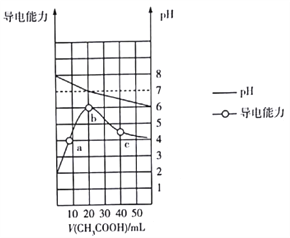
A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com