
����Ŀ������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±��dz����¼���������ʵĵ���ƽ�ⳣ����
���� | ���볣��(Ka��Kb) | �ѣ������� | �ܶȻ�������Ksp�� |
CH3COOH | 1��8��10��5 | BaSO4 | 1��10-10 |
HNO2 | 4��6��10��4 | BaCO3 | 2.6��10-9 |
HCN | 5��10��10 | CaSO4 | 7��10-5 |
HClO | 3��10��8 | CaCO3 | 5��10-9 |
NH3��H2O | 1��8��10��5 |
��ش��������⣺
��1�������������У������������� (�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ���̶��������볣������IJ�����(�����)��
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ�� (ѡ����ԡ������ԡ����ԡ�)�������� �� ��Һ�и�����Ũ�ȴ�С�Ĺ�ϵ����
��3�����ʵ���1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı��Σ��磺BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42-���ʵ���Ũ�ȴﵽ0.01mol��L-1���ϣ�����Һ��CO32-���ʵ���Ũ��Ӧ ��mol��L-1��
���𰸡�
��1��HCN��B
��2�����ԣ��������1�еĵ���ƽ�ⳣ��������ĺ�NH3H2O�ĵ���ƽ�ⳣ����ͬ������CH3COO-��NH4+��ˮ��ƽ��̶���ͬ��c(NH4+)=c(CH3COO-)>c(OH-)=c(H+)
��3��c(Na+)>c(CN-)>c(OH-)>c(H+)
��4��0.26
����������(1)����һԪ���ᣬ����ƽ�ⳣ��Խ��������Խǿ����֮������Խ����HCN�ĵ���ƽ�ⳣ����С�����������������ݴ���ĵ���ƽ�⣺CH3COOH ![]() CH3COO-+H+��
CH3COO-+H+��
A�������¶ȣ�����̶�������ƽ�ⳣ������A����
B����ˮϡ�ͣ�����̶�������ƽ�ⳣ�����䣬��B��ȷ��
C����������CH3COONa���壬������Ĵ�����Դ���ĵ���ƽ�����������ã�����̶ȼ�С������ƽ�ⳣ�����䣬��C����
D�������������ᣬ�����Ũ��������ԽϡԽ�������ʵ�������̶ȼ�С��ƽ�ⳣ�����䣬��D����
(2)�������Һ�У�����ˮ���Լ��ԣ�笠�����ˮ�������ԣ�CH3COOH��NH3H2O�ĵ���ƽ�ⳣ����ȣ�CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ�����Ժͼ��Գ̶��൱����Һ�����ԣ���c(H+)=c(OH-)�����ݵ���غ㣺c(NH4+)+c(H+)=c(Cl-)��c(H+)=c(OH-)��c(H+)+c(NH4+)=c(Cl-)+c(OH-)���ó�c(NH4+)=c(Cl-)���Ҵ���ˮ�����ɵ�c(H+)��c(OH-)����c(NH4+)=c(CH3COO-)��c(H+)=c(OH-)��
(3)���ʵ���֮��Ϊ1��1��NaCN��HCN�Ļ����Һ����pH��7��˵����������ӵ�ˮ��̶ȴ���������ĵ���̶ȣ�������ҺC(OH-)��C(H+)���ʼ��ԣ����ݵ���غ�֪��C(OH-)+c(CN-)=C(H+)+C(Na+)������c(CN-)��C(Na+)�����Ը�����Ũ�ȴ�С˳����C(Na+)��c(CN-)��C(OH-)��C(H+)��
(4)SO42-���ʵ���Ũ��Ϊ0.01molL-1ʱ�������ӵ�Ũ��Ϊ��c(Ba2+)= ![]() mol/L=1��10-8mol/L����ʹSO42-���ʵ���Ũ�Ȳ�С��0.01molL-1 �� ������Ũ��Ӧ�ô���1��10-8mol/L����������Ũ��Ϊ1��10-8mol/Lʱ������Һ��̼�������Ũ��Ϊ��
mol/L=1��10-8mol/L����ʹSO42-���ʵ���Ũ�Ȳ�С��0.01molL-1 �� ������Ũ��Ӧ�ô���1��10-8mol/L����������Ũ��Ϊ1��10-8mol/Lʱ������Һ��̼�������Ũ��Ϊ�� ![]() mol/L=0.26mol/L�����Ե�̼�������Ũ�ȡ�0.26mol/Lʱ��������Ũ��С��1��10-8mol/L����SO42-���ʵ���Ũ�Ȳ�С��0.01mol/L��
mol/L=0.26mol/L�����Ե�̼�������Ũ�ȡ�0.26mol/Lʱ��������Ũ��С��1��10-8mol/L����SO42-���ʵ���Ũ�Ȳ�С��0.01mol/L��
�ʴ�Ϊ����1��HCN��B����2�����ԣ�CH3COOH��NH3H2O�ĵ���ƽ�ⳣ����ȣ�CH3COO-��NH4+�����Ũ��ʱ��ˮ��̶���ͬ��c(NH4+)=c(CH3COO-)��c(H+)=c(OH-)����3��c(Na+)��c(CN-)��c(OH-)��c(H+)����4��0.26
��1������ƽ�ⳣ�������ڱ�ʾ�������Ե�ǿ����ƽ�ⳣ��ֵԽС������Խ������ϵ���ƽ���ƶ�����
��2���ɱ������ݿ�֪��CH3COOH��NH3��H2O�ĵ��볣����ͬ�������Ӧ���ӵ�ˮ��̶�Ҳ��ͬ��
��3�������Һ��pH��7��˵����Һ�Լ��ԣ���CN-��ˮ��̶ȴ���HCN�ĵ���̶ȣ��ݴ˽�ϵ��롢ˮ��ķ���ʽ���з�����
��4�����BaSO4��BaCO3���ܶȻ����м��㡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��������ƽ����þ��25.3g��1g���������룩������þ�۷������̣�����ƽƽ��ʱ������ȡ��þ�۵�ʵ�������ǣ� ��
A.25.2gB.24.8gC.24.7gD.25.7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�м�������ʵ�����Ag+��Pb2+��Na+��SO42����NO3����Cl�� �� ����Һ�����ö��Բ������缫�ĵ����У�ͨ��Ƭ�̺������������뻹ԭ���������֮��Ϊ�� ��
A.35.5��108
B.16��207
C.8��1
D.108��35.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£����淴Ӧ��2NO��g��+O2��g��![]() 2NO2��g��������̶����ܱ������н��У��ﵽƽ��״̬�ı�־���ǣ�������
2NO2��g��������̶����ܱ������н��У��ﵽƽ��״̬�ı�־���ǣ�������
����λʱ��������n mol O2��ͬʱ����2n mol NO2����λʱ��������n mol O2��ͬʱ����2n mol NO����NO2��NO��O2��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬������������ɫ���ٸı��״̬�����������ܶȲ��ٸı��״̬����������ѹǿ���ٸı��״̬����������ƽ����Է����������ٸı��״̬��
A. �٢ܢޢ� B. �ڢۢݢ� C. �٢ۢܢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��գ�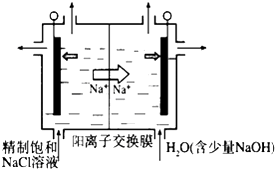
��1������ͼʾ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2��д����������ClO2�ĵ缫��Ӧʽ�� ��
�ڵ��һ��ʱ�䣬�������������������Ϊ112mL����״����ʱ��ֹͣ��⣮ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊmol����ƽ���ƶ�ԭ������������pH�����ԭ����
��2��ClO2����ˮ��Fe2+��Mn2+��S2-��CN-�������Ե�ȥ��Ч����ij������ˮ�к�CN-amg/L������ClO2��CN-������ֻ�����������壬�����ӷ�Ӧ����ʽΪ������100m3������ˮ��������ҪClO2mol��
��3��Ϊ��״�ȼ�ϵ������ʣ���ѧ�ҷ�����һ��ȼ�ϵ�أ���ص�һ���缫ͨ���������һ���缫ͨ��״����壬������Dz�����Y2O3��ZrO2���壬�ڸ��������ܴ���O2������ع���ʱ������ӦʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱKsp[Mg(OH)2]=1.8��10-11��Ksp [Fe(OH)3]=8.0��10-38��Kb(NH3��H2O)= 1.8��10-5��������������ȷ����
A. Mg(OH)2��Fe(OH)3�ı�����Һ��c(OH-)�Ĵ�С˳����Mg(OH)2>Fe(OH)3��25��ʱ�����Ũ�ȵ�MgCl2��FeCl3�����Һ����μ��백ˮ���ȳ��ֺ��ɫ������
B. 25��ʱ���Ӵ���ˮϡ�Ͱ�ˮ������̶�������ҺpH��С
C. 25��ʱ��NH4++H2O![]() NH3��H2O+H����ƽ�ⳣ��Ϊ5.6��10-10
NH3��H2O+H����ƽ�ⳣ��Ϊ5.6��10-10
D. ��0.02 molL-1MgCl2��Һ��0.02 molL-1NaOH��Һ�������ϣ�û�г�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����д��ڵĹ��ۼ�������ȫ��ͬ(�ӦҼ����м����γɷ�ʽ�Ƕȷ���)����(����)
A. CH4��NH3 B. C2H6��C2H4
C. H2��Cl2 D. Cl2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
��CO(g)��![]() O2(g)===CO2(g)����H����283.0 kJ��mol��1
O2(g)===CO2(g)����H����283.0 kJ��mol��1
��H2(g)��![]() O2(g)===H2O(g)����H����241.8 kJ��mol��1
O2(g)===H2O(g)����H����241.8 kJ��mol��1
����˵����ȷ����(����)
A. ͨ��״���£�������ȼ����Ϊ241.8 kJ��mol��1
B. �ɢٿ�֪��1 mol CO(g)��![]() mol O2(g)��Ӧ���� 1 mol CO2(g)���ų�283.0 kJ������
mol O2(g)��Ӧ���� 1 mol CO2(g)���ų�283.0 kJ������
C. ������ͼ��ʾ2CO2(g)===2CO(g)��O2(g)��Ӧ�����е������仯��ϵ
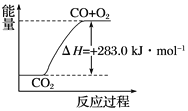
D. �ֽ�1 mol H2O(g)���䷴Ӧ��Ϊ��241.8 kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com