
【题目】为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)上述实验中第⑤步操作需要烧杯、____________、___________等玻璃仪器。
(2)判断BaCl2已过量的方法是 。
(3)第④步中所有相关的化学方程式是 、 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
【答案】(10分)
(1)玻璃棒 ;漏斗
(2)向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(3)CaCl2+Na2CO3=CaCO3↓+ 2 NaCl ;BaCl2+Na2CO3=BaCO3↓+ 2 NaCl;
(4)在此酸性条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。
【解析】
试题分析:(1)过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为:烧杯、玻璃棒、漏斗,故答案为:玻璃棒;漏斗;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,故答案为:向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(3)过量碳酸钠可将溶液中的杂质离子钙离子以及多余的钡离子除去,反应方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(4)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度。


科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件及部分产物未标出)。已知:A是正盐,B是能使品红溶液褪色的气体;G是红棕色气体。按要求回答问题:
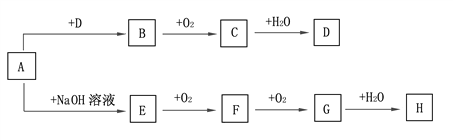
(1)写出下列物质的化学式:A. ___________, B.____________, C.____________。
(2)A→B的离子方程式:________________________________________;
E→F的化学方程式:__________________________________________;
H的浓溶液与铜反应的离子方程式:_______________________________。
(3)检验某溶液中含D中阴离子的方法是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列结论正确的是( ) 
A.该有机物分子式为C13H16
B.该有机物属于苯的同系物
C.该有机物分子至少有4个碳原子共直线
D.该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解2L 1molL﹣1的硫酸铜溶液,在电路中通过0.5mol电子后,将电源反接,电路中又通过1mol电子,此时溶液中c(H+)是(设溶液体积不变)( )
A.1.5 molL﹣1
B.0.5 molL﹣1
C.0.75 molL﹣1
D.0.25 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇.制备原理如图1: 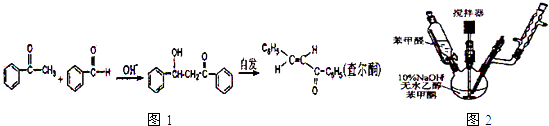
(1)制备过程中.需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是(填“放热”或“吸热”)反应.如温度过高时,则可采用措施.
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是 .
(3)结晶完全后,需抽滤收集产物.’抽滤装置(图2)所包含的仪器除减压系统外还有、(填仪器名称).
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过法来判断原料是否反应完全以及反应的转化率和选择性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品.理论上k=
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42﹣等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②盐酸 ③BaCl2 , 这三种试剂添加的合理顺序是(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过. 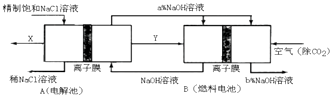
①图中X、Y分别是、(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 .
②分别写出燃料电池B中正极、负极上发生的电极反应:、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列物质占体积最大的是( )。
A. 18g H2O B. 6.02×1023个氮分子 C. 44.8L HCl D. 6g氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对叔丁基苯酚 ![]() 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: 步骤l:组装仪器,用量筒量取2.2mL叔丁基氯(过量),称取1.6g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗.
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: 步骤l:组装仪器,用量筒量取2.2mL叔丁基氯(过量),称取1.6g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗.
步骤2:向A中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,反应有气体放出.
步骤3:反应结束后,向A中加入8mL水和1mL浓盐酸,即有白色固体析出.
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8g.
(1)仪器A和B的名称分别为; .
(2)步骤2中发生主要反应的化学方程式为 . 该反应为放热反应,且实验的产率通常较低,可能的原因是 .
(3)图1中倒扣漏斗的作用是 . 苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用洗涤.
(4)步骤4中用石油醚重结晶提纯粗产物,试简述重结晶的操作步骤:
(5)实验结束后,对产品进行光谱鉴定,谱图结果如图2.该谱图是(填字母). 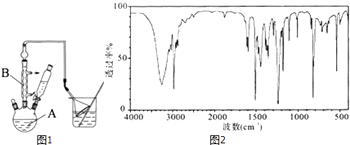
A.核磁共振氢谱图
B.红外光谱图
C.质谱图
(6)下列仪器在使用前必须检查是否漏液的是(填选项字母).
A.量筒
B.容量瓶
C.滴定管
D.分液漏斗
E.长颈漏斗
(7)本实验中,对叔丁基苯酚的产率为(请保留三位有效数字).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com