
����Ŀ����ش��ȼҵ���������⣺
��1���������ռ��ǵ��ʳ��ˮʱ���չ̶��ı���k�������ȣ����ɵIJ�Ʒ��������k=
��2��ԭ�ϴ����г�������ɳ��Ca2+��Mg2+��Fe3+��SO42�������ʣ����뾫�ƺ���ܹ����ʹ�ã�����ʱ����������ˮ���˺�Ҫ������Լ��ֱ�Ϊ��Na2CO3�������� ��BaCl2 �� �������Լ����ӵĺ���˳����������ţ�
��3���ȼҵ�Ǹߺ��ܲ�ҵ��һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խ���30%���ϣ������ֹ�������У�������ϵĴ�����ת����ϵ��ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ���� 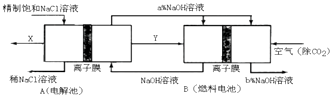
��ͼ��X��Y�ֱ��������ѧʽ���������Ƚ�ͼʾ������������������a%��b%�Ĵ�С ��
�ڷֱ�д��ȼ�ϵ��B�������������Ϸ����ĵ缫��Ӧ���� ��
���𰸡�
��1��![]() =
= ![]() =1��1.13��0.89
=1��1.13��0.89
��2���ۢ٢�
��3��Cl2��H2��a%��b%��O2+4e��+2H2O=4OH����H2��2e��+2OH��=2H2O
���������⣺��1����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������������k=
2NaOH+H2��+Cl2������������k= ![]() =
= ![]() =1��1.13��0.89�����Դ��ǣ�
=1��1.13��0.89�����Դ��ǣ� ![]() =
= ![]() =1��1.13��0.89����2��Ӧ�ȼ������BaCl2 �� ��ȥSO42�� �� Ȼ��ӹ���Na2CO3 �� �ɳ�ȥCa2+��Mg2+��Fe3+�ȣ����˺��������ɳ�ȥNa2CO3 �� ���Դ��ǣ��ۢ٢ڣ���3����ͨ����һ��Ϊ��������ԭ��Ӧ������ô��߱�ȻͨH2 �� ����Y��ΪH2 �� ��������ӦΪ����������Cl2 �� ����ȼ�ϵ����������O2+4e��+2H2O=4OH�� �� ȼ�ϵ���е�����Ĥֻ����������ͨ������ȼ�ϵ�������������õ����Ӳ���OH�� �� ���Է�Ӧ���������Ƶ�Ũ�����ߣ���a%С��b%����֪NaOHŨ������
=1��1.13��0.89����2��Ӧ�ȼ������BaCl2 �� ��ȥSO42�� �� Ȼ��ӹ���Na2CO3 �� �ɳ�ȥCa2+��Mg2+��Fe3+�ȣ����˺��������ɳ�ȥNa2CO3 �� ���Դ��ǣ��ۢ٢ڣ���3����ͨ����һ��Ϊ��������ԭ��Ӧ������ô��߱�ȻͨH2 �� ����Y��ΪH2 �� ��������ӦΪ����������Cl2 �� ����ȼ�ϵ����������O2+4e��+2H2O=4OH�� �� ȼ�ϵ���е�����Ĥֻ����������ͨ������ȼ�ϵ�������������õ����Ӳ���OH�� �� ���Է�Ӧ���������Ƶ�Ũ�����ߣ���a%С��b%����֪NaOHŨ������
���Դ��ǣ�Cl2��H2��a%С��b%�� ��ȼ�ϵ�������������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e��+2H2O=4OH�� �� ��������ʧ���ӷ���������Ӧ���缫��ӦʽΪH2��2e��+2OH��=2H2O��
���Դ��ǣ�O2+4e��+2H2O=4OH����H2��2e��+2OH��=2H2O��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ�����������5���е���Щ���ݣ����¶���Ũ����������ѹǿ �ݿ̶����� ����
A. �٢ۢ� B. �ۢܢ� C. �٢ڢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaOH��AlCl3��MgCl2���ֹ�����ɵĻ������������ˮ�У���0.58 g��ɫ���������������õ���Һ�У���μ���0.5 mol��L-1�����ᣬ�����������������ɳ�����������ϵ��ͼ��ʾ��

��1���������NaOH��������______ g��
��2��P������ʾ�����������Ϊ______ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����е�CaCl2��MgCl2��FeCl3��Na2SO4 �Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
![]()
��1������ʵ���е�����������Ҫ�ձ���____________��___________�Ȳ���������
��2���ж�BaCl2�ѹ����ķ����� ��
��3����������������صĻ�ѧ����ʽ�� �� ��
��4�������������pHֵ�ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����о�������Ļ�ѧ�ɷ�ʱ����������������Ԫ���ڷ��������Ҳ�����ڣ���һ��ʵ��Ҫ˵������ ��
A. �����������û������
B. ������Դ�ڷ�����
C. �������������������
D. ����������������ͳһ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǡ�NaNO2���ʰ����С�մ���dz�����ʳƷ���Ӽ�������˵����ȷ����
A.���ǵ���Ҫ�ɷ�Ϊ����
B.NaNO2�ɴ���ʳ������ζ��
C.�ʰ���(һ�ְ�����)���ڵ�����
D.С�մ��ڴ�����������ͷʱ�������ɼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ����Ӧ�õ��������߿Ƽ�����
��1����֪�����ڽ���Ԫ��A��B���䵥�ʵ�λ������ȼ���ȴ�����ȼ�ϣ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
�����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
A | 899.5 | 1757.1 | 14848.7 | 21006.6 |
B | 738 | 1451 | 7733 | 10540 |
�ٸ����������ݷ�����B�����ڱ���λ�����������ӦΪ��
����ijͬѧ��Bԭ�ӵĻ�̬��Χ�����Ų�ʽд����ns1np1 �� Υ����ԭ����
��BԪ�صĵ�һ�����ܴ���Al��ԭ������
��2��������Ϊһ�������Դ�����������Ĵ������⣬C60������������ϣ�����֪���ʯ�е�C��C�ļ���Ϊ154.45pm��C60��C��C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ���������� ��
��C60������ÿ��̼ԭ��ֻ�����ڵ�3��̼ԭ���γɹ��ۼ�����ÿ��̼ԭ������㶼����8��������ȶ��ṹ����C60�����ЦҼ���м�����Ŀ֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�֡������е������Լ����ա����ȶ�����ģ���֪�������ԣ�IO3����Fe3+��I2����ԭ�ԣ�S2O ![]() ��I��
��I��
3I2+6OH��=IO3��+5I��+3H2O��KI+I2�TKI3
��1��ijѧϰС��Լӵ��ν�������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ���ټ�KSCN��Һ���Ժ�ɫ���ú�ɫ���������û�ѧʽ��ʾ����CCl4�����Ϻ�ɫ�����������õ���ʽ��ʾ����
�ڵڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ�� ��
��2��KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� ��
��I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ�����ǡ�������˵������ ��
��3��Ϊ����ӵ��Σ�����KI�����ȶ��ԣ��ɼ��ȶ������ٵ����ʧ�������������п�����Ϊ�ȶ������� �� A��Na2S2O3 B��AlCl3 C��Na2CO3 D��NaNO2
��4���Ժ�Fe2+�϶��ʳ�Σ����費��Fe3+������ѡ��KI��Ϊ�ӵ���������ʵ�鷽��������üӵ����е�Fe2+ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵľ��壬��ѧ��������ͬ����������Ҳ��ͬ���ǣ� ��
A.SO2��SiO2
B.NaOH��NaCl
C.NH4Cl ��HCl
D.H2O2��C3H6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com