
【题目】如图表示反应X(g)4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线 
(1)200℃时,5min内用Y表示平均反应速率 .
(2)200℃在8min时,Z的浓度为 .
(3)200℃在时刻,反应达到平衡.
(4)200℃时,第7min时刻,V(正)V(逆)(填“>”、“<”、“=”).
(5)从图中可以看出,200(填“>”、“<”、“=”).
【答案】
(1)0.64mol?L﹣1?min﹣1
(2)0.85mol?L﹣1
(3)6min
(4)=
(5)>
【解析】解:(1)5min内X浓度变化为1.0mol/L﹣0.2mol/L=0.8mol/L,v(X)= ![]() =0.016molL﹣1min﹣1 , v(Y)=4×0.016molL﹣1min﹣1=0.64molL﹣1min﹣1 , 所以答案是:0.64molL﹣1min﹣1;(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,所以答案是:0.85mol/L;(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,所以答案是:6min;(4)7min达到化学平衡状态,V(正)=V(逆),所以答案是:V(正)=V(逆);(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,所以答案是:>.
=0.016molL﹣1min﹣1 , v(Y)=4×0.016molL﹣1min﹣1=0.64molL﹣1min﹣1 , 所以答案是:0.64molL﹣1min﹣1;(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,所以答案是:0.85mol/L;(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,所以答案是:6min;(4)7min达到化学平衡状态,V(正)=V(逆),所以答案是:V(正)=V(逆);(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,所以答案是:>.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程) 
(1)反应生成的气体的体积(标况下);
(2)反应过程中转移电子的物质的量;
(3)参加反应的稀硝酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种应用广泛的氧化剂和漂白剂。
(1)亚氯酸钠(NaClO2)中氯元素的化合价是____________;
(2)某同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。该同学利用下图所示装置制取NaClO2晶体:

①装置B中盛装浓硫酸的仪器名称是______,装置C的作用是_________;
②已知装置B中的产物有ClO2气体,装置B中反应的化学方程式为___________________;
③装置D中发生反应的化学方程式为______________________________,反应后的溶液中除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有一种阴离子是_____,检验该离子的方法是_____________;
④反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后趁热过滤,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。如果撤去装置D中的冷水浴,可能导致产品中混有的杂质是______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 使用容量瓶配制溶液时,应先检漏,且干燥后才能使用
B. 使用pH试纸时用手捏住即可
C. 利用丁达尔效应鉴别蛋白质溶液和MgCl2溶液
D. 新制氯水保存在棕色广口瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaCl、K2CO3、NH4Cl三种盐溶液酸碱性判断正确的是( )
A.酸性 中性 碱性B.碱性 酸性 中性
C.中性 酸性 碱性D.中性 碱性 酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50mL0.50mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如右下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是

A. 如右图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存的无色离子组是( )
A. K+、Mg2+、Cl-、MnO4-B. Ba2+、NO3-、NH4+、Cl-
C. K+、Na+、SO32-、Cl-D. Na+、Cu2+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ①______ | 第三 | ②______ |
③______ | 3d54s1 | ④______ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________。
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____,Ni(CO)4是_____(填“极性”或“非极性”)分子。
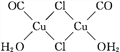
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____个配位键,____个σ键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com