
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是 (填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为________色, 且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L。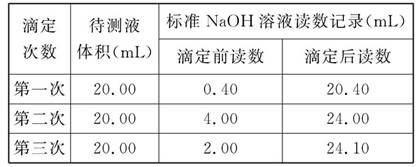
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。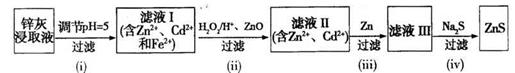
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12 (mol/L)3,要使0.2mol/lMgSO4溶液中的Mg2+沉淀较为完全[c(Mg2+)<5.6×10-6mol/L],则应向溶液中加入NaOH溶液,使溶液的pH最小为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
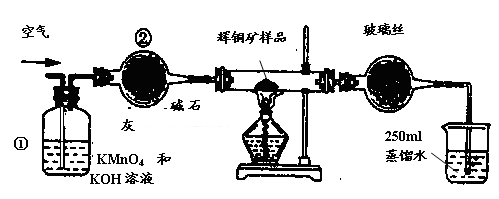
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用NaOH固体配制0.1 000mol·L-1NaOH溶液500mL.
(1)用托盘天平称取NaOH固体________g.溶液配制过程用到下列玻璃仪器,按首次使用的先后顺序依次是________ (填仪器选项符号)
A.玻璃棒 B.胶头滴管 C.烧杯 D.500mL容量瓶
(2)用所配制的0.1000mol·L-1NaOH溶液通过中和滴定测定一元弱酸HA溶液浓度,每次滴定取用的HA溶液均为20.00mL,使用酚酞溶液为指示剂,滴定终点的标志是____________________________。滴定的实验数据记录:
| 滴定次数 | NaOH溶液体积(mL) | |
| V1 | V2 | |
| 1 | 3.05 | 44 |
| 2 | 1.45 | 41.5 |
| 3 | 7.65 | 47.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl3 + 3H2。
完成下列填空: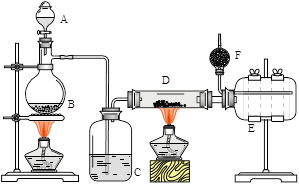
(1)写出B处烧瓶中发生反应的化学方程式:_______________________________________。
(2)C中盛有的试剂为__________。进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D、E的目的是_________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
E瓶的作用是_______________________________________________________。
(4)F中盛有碱石灰,其目的是_________(选填序号)。
a. 吸收HCl b. 吸收Cl2 c. 吸收CO2 d. 吸收H2O
(5)①将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是_____________________________________________。
②若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为_______。
(6)有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3。事实证明这样做比较危险,请简述理由 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述错误的是( )
| A.废弃的干电池不能随意丢弃,但可以土埋处理 |
| B.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| C.不能将铁制自来水管与铜制水龙头连接使用 |
| D.电化学腐蚀过程中存在电极反应,产生微电流 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com